タンパク質は栄養素として身近な存在であり、その重要性は誰でもが認識していると思います。しかし、なぜ重要なのか、そもそもどれくらいの種類があって、何をやっている から重要なのか、となると、必ずしも理解しているとは言えないかもしれません。まず種類ですが、数え方にもよりますし、まだ推定の域を出ない部分もあります が、ヒトでは2万数千から4万種類くらいあるとされています。とりあえずここでは4万種類ということにして話を進めていきます。生物種が違うと、もっているタ ンパク質の種類も数も違いますので、地球上のすべてのタンパク質の種類となると膨大な数となります。
次に、なぜ重要かと言えば、一言で言えば、生命現象のあらゆる場面でいずれかのタンパク質が関与しているから、ということになります。 そうした種類の多さ、機能の多様さにもかかわらず、いずれのタンパク質もたった20種類のアミノ酸だけが構成単位として使われています。タンパク質の種類の違いとは、その アミノ酸のつながる順番、アミノ酸配列の違いであり、アミノ酸配列が異なるだけで、さまざまな生物学的機能を発揮することができる、まさに驚異の分子なので す。
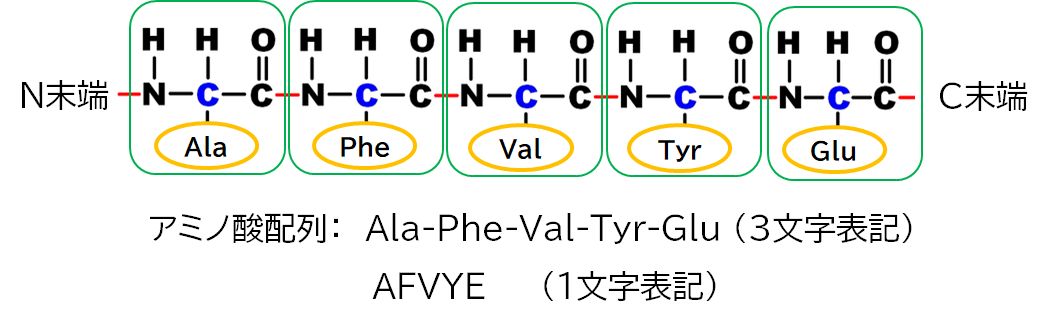
タンパク質はアミノ酸を基本単位とし、それらが紐状につながった分子です(図3.1)。1つのアミノ酸は主鎖と側鎖に分けることができ、主鎖部分は共通で側鎖の種類に よって 20種類に分類されています。表3.1に20種類のアミノ酸を掲げました。この講義では、これらの化学構造や名前を覚える必要はありません。ただ、アミノ酸には 20種類あること、そしてアミノ酸の表記の仕方にいろいろあることだけ知っていただければ結構です。アルファベット1文字(表3.1の赤字)、3文字の省略形 (表 3.1のAla、Cysなど)、フルネーム(表3.1の英語およびカタカナ表記)などがありますが、この講義では基本的にはアルファベット1文字表記を採用し、場合に よって、3文字表記やフルネーム表記を併用することにします。

| A = Ala = Alanine アラニン |
G = Gly = Glycine グリシン |
M = Met = Methionine メチオニン |
S = Ser = Serine セリン |
| C = Cys = Cysteine システイン |
H = His = Histidine ヒスチジン |
N = Asn = Asparagine アスパラギン |
T = Thr = Threonine スレオニン |
| D = Asp = Aspartic acid ア スパラギン酸 |
I = Ile = Isoleucine イソロイシン |
P = Pro = Proline プロリン |
V = Val = Valine バリン |
|
E = Glu = Glutamic acid
グ
ルタミン酸 |
K = Lys = Lysine リジン |
Q = Gln = Glutamine グルタミン |
W = Trp = Triptophan トリプトファン |
| F = Phe = Phenylalanine フェニールアラニン |
L = Leu = Leucine ロイシン |
R = Arg = Arginine アルギニン |
Y = Tyr = Tyrosine チロシン |
それぞれのタンパク質はそのアミノ酸配列で特定されます。多くの場合、アミノ酸配列はアミノ酸の1文字表記を用いて表します。紐状のタンパク質の両端に もDNAと同様区別があり、N末端とC末端と名付けられています。そして、N末端からC末端に向かってアミノ酸名を列記することになっています。これは、タン パク質が生合成されるときアミノ酸が結合されていく順番です。
図3.1に、アミノ酸の3文字表記と1文字表記によって、上段に示したタンパク質のアミノ酸配列を表示しています。また、表3.2には、3種類の実在のタンパク質のアミ ノ酸配 列を1文字表記で示しました。ミオグロビンは酸素の貯蔵を担うタンパク質、アルコール脱水素酵素はお酒を飲んだときアルコールを分解してくれる酵素、青色感受性オプシンは 光の3原色の一つ、青色の光に反応するタンパク質です。 表3.2のアミノ酸配列を眺めてください。特に規則性があるような並び方ではありません。何も説明がなければ、ランダムとも言えそうな配列です。それでも、それぞれがその タン パク質固有のアミノ酸配列です。タンパク質の多様な機能は、このように20種類のアミノ酸配列によって(結合するアミノ酸の数の違いも含めて)実現されます。
表3.2 タンパク質のアミノ酸配列例
一つひとつのアルファベットがアミノ酸の種類を表しています(表3.1参照)
〔例1〕 ミオグロビン (ヒト) 154アミノ酸
MGLSDGEWQLVLNVWGKVEADIPGHGQEVLIRLFKGHPETLEKFDKFKHLKSEDEMKASEDLKKHGATV
LTALGGILKKKGHHEAEIKPLAQSHATKHKIPVKYLEFISECIIQVLQSKHPGDFGADAQGAMNKALEL
FRKDMASNYKELGFQG
〔例2〕 アルコール脱水素酵素 (ヒト) 393アミノ酸
MGTKGKVIKCKAAIAWEAGKPLCIEEVEVAPPKAHEVRIQIIATSLCHTDASVIDSKFEGLAFPVIVGH
EAAGIVESIGPGVTNVKPGDKVIPLYAPLCRKCKFCLSPLTNLCGKISNLKSPASDQQLMEDKTSRFTC
KGKPVYHFFGTSTFSQYTVVSDINLFTAKIDDDANLERVCLLGCGFSTGYGAAINNAKVTPGSTCAVFG
LGGVGLSAVMGCKAAGASRIIGIDINSEKFVKAKALGATDCLNPRDLHKPIQEVIIELTKGGVDFALDC
AGGSETMKAALDCTTAGWGSCTFIGVAAGSKGLTIFPEELIIGRTINGTFFGGWKSVDSIPKLVTDYKN
KKFNLDALVTHTLPFDKISEAFDLMNQGKSVRTILIFGRCQEQFRILSD
〔例3〕 青色感受性オプシン (ヒト) 348アミノ酸
MRKMSEEEFYLFKNISSVGPWDGPQYHIAPVWAFYLQAAFMGTVFLIGFPLNAMVLVATLRYKKLRQPL
NYILVNVSFGGFLLCIFSVFPVFVASCNGYFVFGRHVCALEGFLGTVAGLVTGWSLAFLAFERYIVICK
PFGNFRFSSKHALTVVLATWTIGIGVSIPPFFGWSRFIPEGLQCSCGPDWYTVGTKYRSESYTWFLFIF
CFIVPLSLICFSYTQLLRALKAVAAQQQESATTQKAEREVSRMVVVMVGSFCVCYVPYAAFAMYMVNNR
NHGLDLRLVTIPSFFSKSACIYNPIIYCFMNKQFQACIMKMVCGKAMTDESDTCSSQKTEVSTVSSTQV
GPN
(注) 同じ機能をもつタンパク質でも、生物種が異なるとアミノ酸の配列が少し変わります。一部のアミノ酸が違うアミノ酸に置換されていたり、欠失したり、挿入されていた りします。アミノ酸配列の違いの大きさはおおよそ進化的な距離に比例することが知られていて、進化的に近縁であればあるほど違いは小さく、離れていれば離れて いるほど 違いが大きくなります。また、同じヒトでも1つのタンパク質に1つ、2つ違いがあることはふつうに起こることで、遺伝的個性を生み出しています。これについて は、この講義のなかで何度か例が出てきます。
タンパク質はアミノ酸が結合した紐状の分子です。しかし、その紐状のままゆらゆらしているわけではありません。まとまって球状構造をとるのが一般的です(折れたたむ、 foldするなどと表現します; 図3.2参照)。そのとき、1つのタンパク質がさまざまな形に折れたたまれるのではなく、それぞれのタンパク質固有の形に折 れたたまれます。それをタンパク質の立体構造とよびます。単に、タンパク質分子の立体的な形、と考えていただければ結構です。
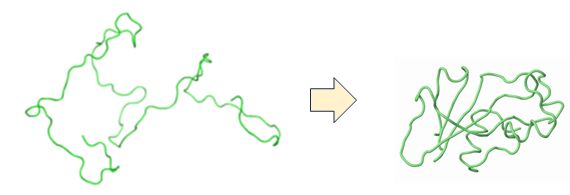
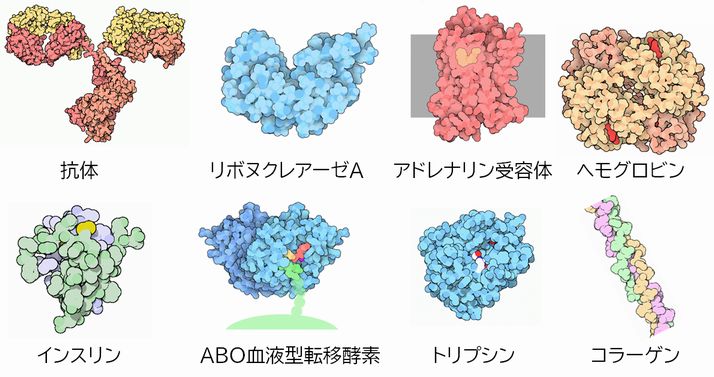
図3.3にいくつかのタンパク質についてその立体構造を示しました。全体的には球状にまるまった感じですが、綺麗な幾何学的な形というわけではなく、それ ぞれ が独特の形をとっているのがわかるかと思います。この形がタンパク質ごとに決まっているのです。そしてこの形に注目した話がこれからの講義の中心となります。 (ちなみに左上の赤と黄色で描かれているのは、最近テレビでよく話題になる抗体です。Yの字型に描かれることが多いのですが、現実にはこんな形をしています)
タンパク質がそれぞれ固有の形をとるのはアミノ酸配列がそれぞれ固有だからです。20種類のアミノ酸にはそれぞれ物理・化学的な個性があります。たとえば、タンパク質が 存在する環境の多くは水の中ですが、水との接触を好む(親水性)アミノ酸もあれば、水との接触を嫌う(疎水性)アミノ酸もあります。したがって、折れたたまる とき親水性アミノ酸は表面に配置され、水と接触しようとしますが、疎水性アミノ酸は水との接触を避けるようにタンパク質内部に埋め込まれようとします。また、 アミノ酸どうしの相互作用も、近接することで安定化に寄与するものもあれば、近接すると互いに反発するものもあります。安定化に寄与するペアはお互いに接近し ようとしますし、反発するペアは接近するのを避けようとします。また、アミノ酸それぞれの大きさの多様性も、球状にパッキングされるときには重要な要素となり ます。こうしたアミノ酸配列の違いは折れたたみのときに反映され、それぞれ独特の立体構造へとタンパク質を導いていくのです。
ただし、どんなアミノ酸配列でも一意的に立体構造が決まるかといえばそうではありません。進化の過程で、一意的な立体構造へと折れたたまるアミノ酸配列だけが選択されて きたと考えられています。したがって、自然界にあるタンパク質の種類は膨大であると上で述べましたが、アミノ酸配列として可能な場合の数の膨大さからすれば、 現存するタンパク質たちは、ほんのわずかな選ばれしエリートたちなのです。
以下にタンパク質の機能を列記しました。この講義では、こうした機能を覚えていただくようなことを意図していませんので、あくまで一部のタンパク質を示し ているにすぎません。これらを眺め、「あらゆる生命現象にタンパク質は関与している」という雰囲気だけを感じていただければそれで十分です。興味が湧いたら、 自分でいろいろ調べてみてください。ただし、この中のいくつかは、今後の講義の中でとりあげられます。そのと き、さらに理解を深めていただきたいと思います。
(1) 構造 〜 ケラチン(毛髪、羊毛、爪などの主成分)、コラーゲン、ウィルスの外套タンパク質
(2) 輸送 〜 ヘモグロビン(’赤血球:酸素の運搬)
(3) 貯蔵 〜 ミオグロビン(筋肉:酸素の貯蔵)
(4) 運動 〜 ミオシン、アクチン(筋肉の成分)、べん毛、モータータンパク質
(5) 代謝(酵素・酵素阻害など)〜 タンパク質分解酵素、グルタミン酸合成酵素、リゾチーム、
アルコール脱水素酵素、A型糖転移酵素・B型糖転移酵素(血液型)
(6) 免疫 〜 免疫グロブリン(抗体)、主要組織適合性抗原、T細胞受容体、インターロイキン
(7) シグナル伝達 〜 インスリン、成長ホルモン、ホルモン受容体、嗅覚受容体、味覚受容体、
神経伝達物質受容体、カルモジュリン、GTP結合タンパク質
(8) 膜(チャンネル・輸送) 〜 Naチャンネル、Caチャンネル、光駆動プロトンポンプ、アクアポリン
(9) DNA複製・転写・翻訳 〜 DNAポリメラーゼ、プライマーゼ、RNAポリメラーゼ
(10) 転写調節 〜 リプレッサー、ホメオボックスタンパク質
(11) その他 〜 毒(へび、蜂)、プリオン(機能未知)、クリスタリン(目の水晶体)、
光と反応するタンパク質(赤・緑・青感受性オプシン、光合成中心)
タンパク質はそれぞれ固有のアミノ酸配列をもち、そのアミノ酸配列によって決まる固有の立体構造をとります。そして、その立体構造がそのタンパク質の機能 と密接に関わっています。タンパク質は、ヒトでは4万種類程度あると推定され、生命現象のあらゆる場面において重要な役割を演じています。これからこの講義で は、タンパク質の立体構造が機能に関わるとはどういうことか、前回お話したDNAとはどのような関係をもつか、そして具体的な生命現象においてこれらのこと がどのように行われているのかを見ていこうと思います。
![]()
タンパク質工学 〜 タンパク質を人工的に設計する
タンパク質立体構造の表現方法 〜 CG(computer graphics)がタンパク質の形を見る最も有用なツール
タンパク質立体構造ギャラリー 〜 さまざまなタンパク質の形 をCGで見てみよう
動物性タンパク質と植物性タンパク質 〜 タンパク質=肉ではない!
アミノ酸配列からタンパク質の形を予測する 〜 AIが画 期的な成果を生み出した!
シャペロン、天然変性タンパク質 〜 タンパク質
立体構造に関するパラダイム変換を迫る