1961年、C.B. アンフィンセンは、リボヌクレアーゼというタンパク質が、生命系の中でなく、実験室においても、それ固有の立体構造へと自発的に折りたたまれることを示しました。このこと を基に、一般にタンパク 質は、生理的な条件の下では、そのアミノ酸配列で決まる固有の立体構造へと自発的に折れたたまると提唱しました。これをアンフィンセンのドグマといいます。ち なみに、彼は、「リボヌクレアーゼの研究、特にアミノ酸配列と生物学的な活性構造の関係に関する研究」によって、1972年、ノーベル化学賞を受賞していま す。
この講義においても、このアンフィンセンのドグマを基礎に、鍵と鍵穴モデルを軸として話を展開していきます。しかしその後、いくつかの例外があることもわ かっています。この講義の流れの中では、その例外にまで言及して、何かを説明することはおそらくないと思いますが、ここで一言触れておこうと思います。
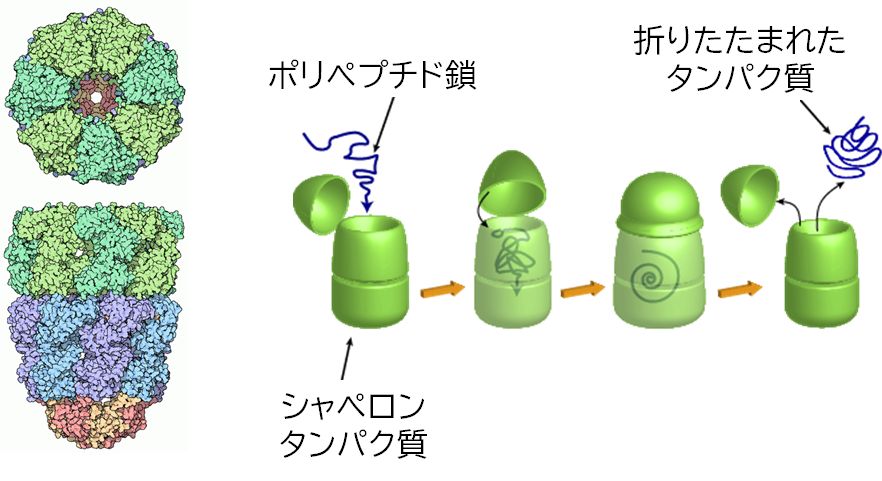
一つ目は、ひとりで折りたたまることができず、他のタンパク質の手助けを受けるタンパク質がある、あるいは逆の言い方をすれば、他のタンパク質の折りたた みを 手助けするタンパク質があるという話題です。実は、実験室系と異なり、現実の細胞の中でのタンパク質の折りたたみは一般にそう簡単な作業ではありません。細胞 の中はタンパク質をはじめさまざまな生体高分子がひしめきあった状態にあります。リボソームで合成されたばかりで、折りたたみの途上にある「ひも」状態のポリ ペプチド鎖はとても不安定で、周りに同様の不安定な「ひも」があると、からまりあって凝集してしまいかねません。また、折りたたまったあとも、高い温度にさら されたりするとかたちが崩れて(変性と言います)、凝集が起こる危険性もあります。 にもかかわらず細胞内でタンパク質が凝集など作らずにはたらいているのは、分子シャペロンとよばれるタンパク質の一群があるからなのです。分子シャペロンは細 胞内でタンパク質がきちんと折りたたまれるのを助けているのです。

注:シャペロン(chaperone)の原義は、「社交界にデビューしたての若きレディーが(周辺 の輩たちとの不適切な関係などを防ぎながら)一人前になるのを介添えする年配の婦人」です。ルノアールの「ムーラン・ド・ラ・ギャレットの舞踏会」で中央の若 い女性の横に立ち、付き添う年配の婦人がそれだということです。

二つ目の話題は、天然変性タンパク質とよばれるものの存在です。タンパク質がとる固有の立体構造を英語では native structure といいます。これを訳して「天然構造」とよびます。タンパク質は、生理的条件とは異なる環境では、変性して、ランダムな構造をとるようになりますが、この対極にある構造と してこの用語が使われます。ところが、生理的条件下においても、その一部が、あるいは全体がランダムな構造をとるタンパク質があることがわかってきたのです。 しかも、決して例外的な存在ではなく、真核生物では、そうした領域は、全タンパク質の3分の1ほどにあるという推定がなされています。それらを総称して、天然 変 性タンパク質とよびます(一部がそうしたランダム構造であるタンパク質も含みます)。英語では intrinsically disordered protein といいます。ランダムな構造が固有の構造であるタンパク質といった意味合いです。最初に述べたアンフィンセンのドグマがタンパク質科学の基本原理として長い間確固たる地位 を占めてきましたが、これは大きなパラダイム変換でした。相互作用する相手と結合するときに固有の形へと折りたたまれるとみられていますが、一概にそうとも言 えない例も見 つかっており、まだ、その意義や実体が完全には理解されていません。ここではそうした話題があることだけお話させていただきました。