生物には生体防御の仕組みがあります。 皮膚や粘膜などの外部との接点で病原体や有害物質などの異物が体内に侵入するのを防ぐ仕組みと、体内に侵入した異物を体から排除する「免疫」という仕組みです。さらに免疫 という言葉には、一度罹った感染症に抗体ができ、二度目の感染に対して抵抗力をもつようになることも含まれています。
免疫というと、侵入した異物を攻撃し、排除する戦闘シーンがそのメインイベントと思われる方が多いと思いますが、この講義ではそこにはあまり重点を置いて いません。免疫でもっとも重要なこと、それは、自と他の認識であることを強調したお話をしようと思っています。われわれは、ヒトとウイルスや細菌を区別するこ と ができます(といっても、ウイルスや細菌の画像を見てですが)。しかし、免疫という現象は、DNAやタンパク質といった分子の世界で起こる出来事です。第1回 の講義で説明しましたように、地球上のすべての生物は、4種類の塩基からなるDNAと20種類のアミノ酸からなるタンパク質を主体としたシステムを構築してい ます。そうした状況の中で、われわれのDNAやタンパク質が、ウイルスや細菌のDNAやタンパク質をいかに自分のものではない、すなわち異物と判断するので しょうか?それが正しく実行できて初めて、ウイルスや細菌を攻撃することができるわけです。もしそれを間違えれば、自らを攻撃しかねない、まさに生死を分かつ ほ どの重大事項なの です。したがって、自と他を判別する方法の不思議さに比べれば、どういう方法で攻撃するかは大したことではない、というのは言い過ぎかもしれませんが、言いたい 気持ちはわかっていただけたでしょうか?
免疫システムをミクロな視点で説明するとき、言及すべき構成要素には、細胞レベルではT細胞(細胞障害性T細胞、ヘルパーT細胞)、B細胞、NK細胞、樹状 細胞、マクロファージ、好中球、好酸球、好塩基球などがあります。また、分子レベルでは、タンパク質が中心になりますが、抗体(あるいはB細胞受容体)、T細 胞受容体、MHC(HLA)、Toll様受容体、サイトカイン、補体などがあります。そしてさらに大切なことは、これら要素間の関係性を理解することが、シス テ ムとしての免疫の理解に欠かせないという点です。というわけで、とても3〜4回の講義でその全容をお話しすることはできません。しかも、まだまだ謎多き学問分 野でもあります。そこで、最も基本的なポイントを押さえながら、登場人物をできるだけ抑え、できるだけ簡略化してお話ししようと思っています。
話の進め方ですが、まず全体像の概略をお話しして、それから個々の事象を詳細に説明するというのが一般的かもしれませんが、いきなり全体像をお話しするのは 、登場人物の多さとそれらの複雑な関係を考えると、話す方も聞く方も混乱するのは目に見えていますので、まずは今回、比較的馴染みのある、抗体に限定したお話 か ら入ろうと思います。そ して次回、全体像から個別の話題へと展開する方法を取りたいと思います。当然のことながら、今回の講義では、抗体と免疫系の他の要素との関係は多少曖昧なままお 話しすることになります。しかし、3〜4回の講義が終わったところで、システム全体のなかでの抗体の位置づけをはじめ、免疫の全体像が描けるのではないかと 思っています。
ウイルスや細菌などが体内に入ったとき、われわれの体にはそれと特異的に反応する物質、抗体が産生されます。抗体は免疫グロブリン immunogloburinともよばれ、Igと略称されることもあります。この抗体の特徴を以下にまとめてみました。
(1) ウイルスや細菌など、外部から侵入したものを抗原とよびます。ウイルスや細菌に対して抗体が産生されると書きましたが、実際には、抗原となるのはもっと広範囲に及び、多種 多様 です。分子レベルでいえば、原則、非自己のタンパク質すべてです。タンパク質以外の物質は、タンパク質と結合すると、その複合体が抗原となることがあります。た だし、タンパク質が分解された小さな断片(ペプチド)や、成分であるアミノ酸そのものは対象から外れます。アレルギーは、花粉や食物に含まれるタンパク質が異 物と 認定され、抗体ができたために起こります。同じ人間どうしでも、臓器移植をすると拒絶反応が出るのも、その臓器に自分とは異なるタンパク質が含まれており、それ が異物と認識され、抗体ができるためです。(タンパク質は種による違いだけでなく、同種の個体間でも違いがあるものがあります)
しかし、そもそもわれわれの食事とは他の生物を食べているわけですし、腸内には細菌叢があって、それこそ異物だらけです。それらすべてに抗体が産生され、排 除されたら大変なことになります。そこで、そうした対象に対しては、免疫寛容といって、免疫反応を抑制する仕組みがあります。自分でないものであっても、攻撃 す る対象と攻撃しない対象との境はどこにあるのか、花粉や食物にアレルギーが出る人と出ない人の境はどこにあるのかなど、興味は尽きないのですが、ここでは、基 本、非自己なるタンパク質に対しては抗体ができるという前提で話を進めていきたいと思います。
(2) 抗体は外来からの異物に対して「特異的」に反応します。たとえば、麻疹の抗体は麻疹ウイルスのみに結合し、インフルエンザウイルスやコロナウイルスには結合しません。
(3) 抗体が産生されるためには、一度感染し、抗原と出会う必要があります。ワクチンも、抗原との出会いを、発症しないようにコントロールしてお膳立てしたものと捉えることがで きます。すなわち、弱毒化したウイルスや、ウイルスの成分を接種することで、疑似的な出会いを設定するわけです。
(4) 抗体は、抗原と出会うと、いかなる抗原に対しても、原則、作られます。新型コロナウイルスのような、これまで誰も感染したことのないウイルスに対しても、感染すれば抗体が できま す。
(5) ひとたび抗体が産生されると、症状は回復へと向かいますが、それだけでなく、その後2度目の感染があったときには、即対応することによって発症が抑えられる、いわゆる「二 度無し」が免疫の特徴の一つとなっています。
(6) 抗体の実体とは、タンパク質です。
さて、こうして抗体の特徴を眺めてくると、ある疑問が湧いてきます。抗体はタンパク質ですから、そのアミノ酸配列の情報はDNAに塩基配列として記述されて いるはずです。ところが、感染して初めて抗体ができること、しかも新型ウイルスに対しても抗体ができることをどう理解したらいいのでしょうか。DNAは親から 譲り受けたものです。親の世代には存在しなかったウイルスに対応する抗体の作り方がDNAに記述されている、というのは、どう考えても論理的に矛盾します。ま た、最初 の感染では発症し、しばらくして抗体が産生されるようになって回復します。しかし、2度目の感染は抑えられます。ということは、麻疹のようなありふれたウイル スに対しても、親からのDNAに麻疹に対する抗体の作り方は書かれておらず、最初の感染で初めて作られるように見えます。逆に、もし親からのDNAにすでに書 かれているとしたら、膨大な種類のウイルスが存在しますから、これらに対する抗体の情報をすべて有限の長さのDNAに記述することは物理的に不可能です。した がって、われわれのDNAは、これらの問題にどのように対応しているかが問題となります。
これは免疫学にとって長い間の謎でした。この謎は1970年代、利根川進さんによって解き明かされました。利根川さんはこの業績によって1986年、ノー ベル生理学医学賞を受賞しました。その仕組みはとても意外な方法であり、その仕組みの発見は生命観にも大きな影響を与えました。利根川さんへのノーベル賞が単 独授賞 であったことに、その業績が傑出したものであったことがうかがわれます。
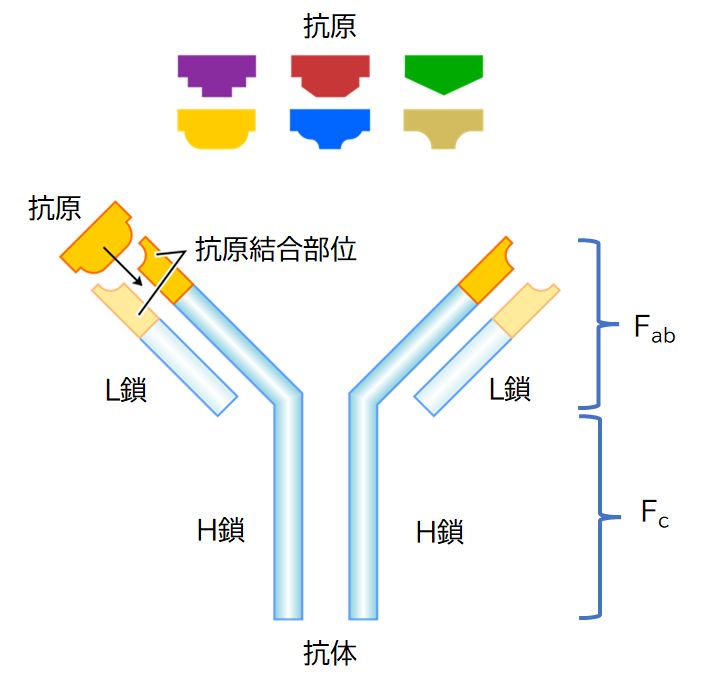
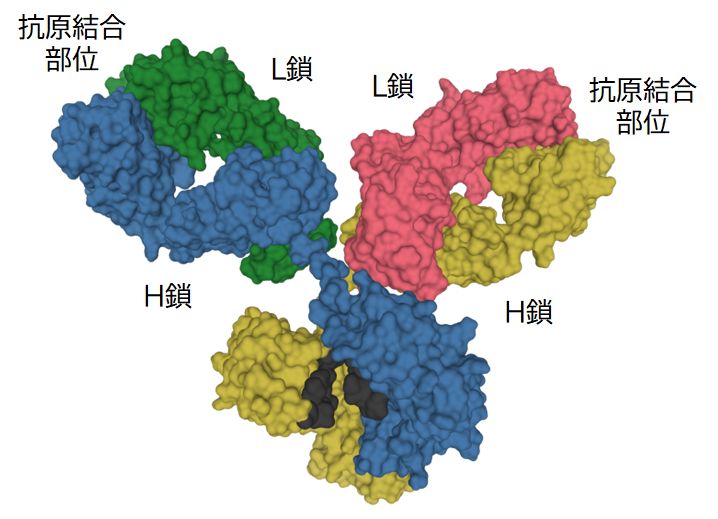
図23.1に抗体の構造を示しました。L鎖2本とH鎖2本からなるY字型のタンパク質で(注)、B細胞が産生します。普段はB細胞表面にあり、このときは B細胞受容体と呼ばれています。後で述べるように、B細胞から分泌されるようになると抗体とよばれるようになります。
対称的な構造をもつY字の2つの先端が抗原結合部位で、ウイルスや細菌などの表面にあるタンパク質に結合します。この抗原結合部位の形はB細胞ごとに異な り、膨大な 種類(1000億種 類以上)があります。なお、1つの抗体の2つの抗原結合部位の形は同じであり、1つのB細胞の表面にあるB細胞受容体もすべて同じ形の抗原結合部位をもっていま す。B細胞受容体は、その抗原結合部位の形により、それぞれ特定の抗原分子とのみ「鍵と鍵穴の関係」で結合します。また、L鎖、H鎖ともに、可変領域と定常領 域に分けられ、抗原結合部位は両鎖の可変領域で形作られています。その意義については、後で触れることになります。
(注) タンパク質に限らず、アミノ酸のつながったものはポリペプチド鎖とよばれます。一つのタンパク質が複数のポリペプチド鎖からなることがあり、その場合には、それぞれにxx 鎖 と名前を付けてよびます。抗体のL鎖、H鎖はLight、Heavyに由来し、そのサイズの違いを反映した命名となっています。


図23.1 (左)抗体分子の模式的構造と抗原との特異的結合を示している
(右)実験データに基づいた抗体の構造。H鎖、L鎖を色分けして示している。
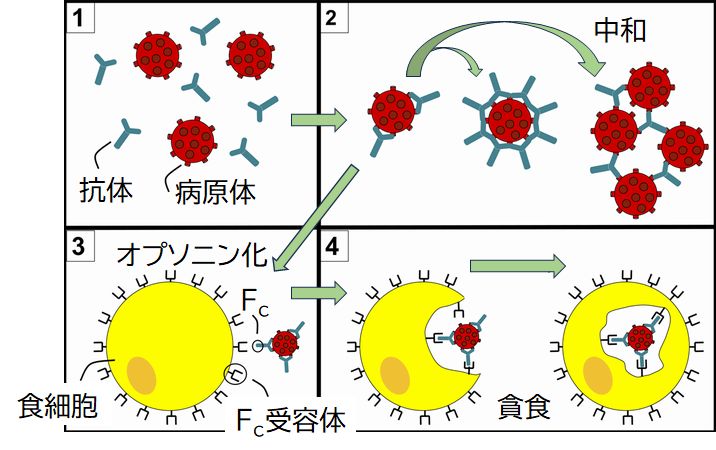
抗体の役割には、抗原分子に結合することで病原体の活動を抑え、宿主細胞への侵入を阻む中和効果と、抗原が結合した抗体の定常領域 (Fc領域 ともよぶ) をマクロファージなど他の免疫細胞の表面にあるFc受容体とよばれるタンパク質に結合させ、マクロファージがこれらを貪食することで抗原を死滅させ るオプソニン効果があります(図23.2)。ちなみに、定常領域とFc受容体も鍵と鍵穴の関係で結合します。
ヒトのゲノム中に含まれる遺伝子の数は数万個であるにもかかわらず、B細胞受容体(抗体)は数千億種類ものレパートリーをもつと推定されています。いった いどのような仕組みで、このような抗体の多様性を生み出すことができるのでしょうか。実は、抗原による刺激を受ける前、それぞれのB細胞が分化する過程で、親 から引き継いだDNAの再構成を行うことによってそれを成し遂げているのです。そしてそれを初めて明らかにしたのが利根川進さんというわけです。
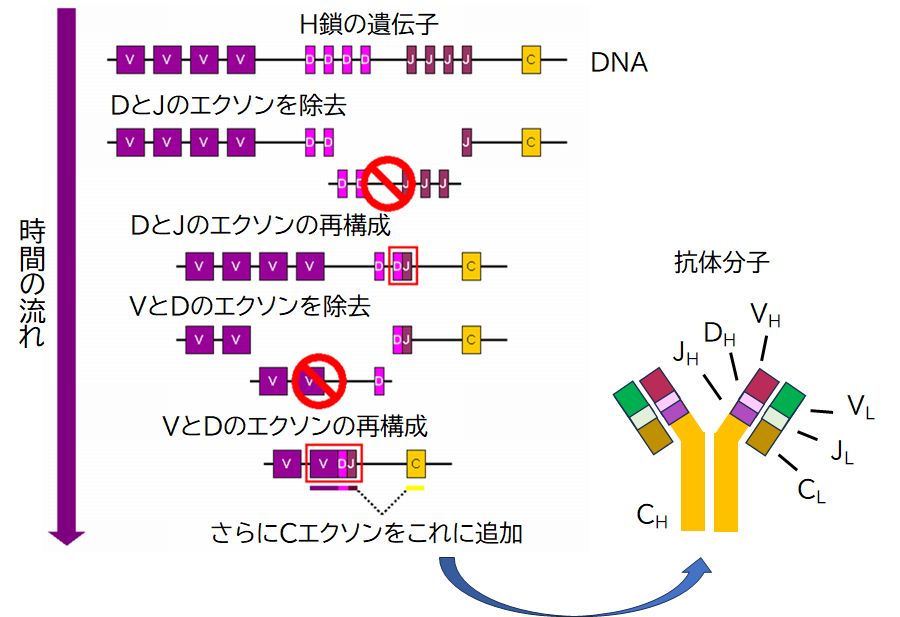
高等脊椎動物の抗体はH鎖とL鎖からなり、さらにL鎖にはκL鎖とλL鎖の2種類があります。遺伝子は、DNA上では、エクソンとよばれる断片に 分けて構成されています(エクソンとエクソンの間にはイントロンとよばれる読み飛ばす塩基配列が存在しています。下記【付録】の「遺伝子のエクソン- イントロン構造」を参照してください)。H鎖はV断片、D断片、J断片という3つのエクソンが抗体の可変領域に対応し、4つのC断片が定常領域に対応していま す。一方、L鎖(κL鎖とλL鎖)では、V断片、J断片という2つのエクソンが可変領域、1つのC断片が定常領域に対応します。ポイントは、この可変領域に対 応 するエクソンが、1種類ではなく多数あることです。ヒトのB細胞を見ると、H鎖ではV断片、D断片、J断片のエクソンがそれぞれ51(VH1〜51)、 27(DH1〜27)、6(JH1〜6)種類あり、κL鎖ではV断片とJ断片がそれぞれ40(Vκ1〜35)、5(Jκ1〜5)種類、λL鎖では 30(Vλ1〜30)、4(Jλ1〜4)種類あります。(注: 各断片のエクソン数は文献によって少し違いますし、おそらく個人差もあるでしょう)。そして、各B細胞はその中から一つずつを選択して、それらを結合した新たなDNAを作 ります。これを遺伝子の再構成といいます(図23.3)。
可変領域に対して複数の断片をもつことで、H鎖は51×27×6 = 8,262種類作ることが可能ですし、κLとλLでは、それぞれ40×5 = 200種類、30×4 = 120種類作ることが可能です。しかも抗体はH鎖とL鎖の組み合わせとなりますから、8,626種類のH鎖と200 + 120 = 320種類のL鎖を組み合わせて、8,626×320 = 280万通りの可変領域の構造、すなわち抗原結合部位の形を作り出すことが可能となります。それだけではありません。さらに、これらの断片間をつなぐ部分にランダムに変異 を起こ すことで、数千億種類もの抗原結合部位の形を作り出すことができると推定されています。
ところで、われわれは麻疹に罹ると麻疹の抗体ができます。それでは、どのエクソンの組み合わせが麻疹の抗体となるかは、DNAにどのように書かれているの で しょうか。実は、それは遺伝情報には書かれていないのです。各B細胞は、どの抗原のための抗体などということはまったく考えず、ただランダムにエクソンを組み合 わせ、変異も起こし、DNAの再構成を行っているのです。そんなB細胞が、あるとき自身の細胞表面にもつB細胞受容体(後の抗体)が抗原分子と「鍵と鍵穴 の関係」で結合し、さらにヘルパーT細胞によって活性化されると(この部分は次回にお話しします)、そこで初めて増殖を開始し、B細胞受容体を盛んに産生し、 細胞外へと分泌します(図23.4)。これが抗体なのです。
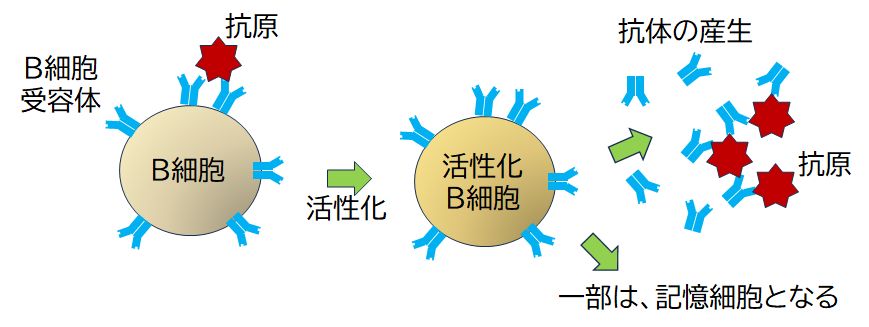
図23.4 抗原による刺激(抗原のB細胞受容体への結合)B細胞の活性化と抗体の産生
したがって、麻疹に感染して初めて、その何千億種類もあるB細胞受容体のなかから麻疹ウイルスに結合するものを探し出すのです。そのため、感染してから抗 体 ができるまで時間がかかり、多くの場合、発症してしまいます。また、ほとんどのB細胞受容体は、生涯結合する相手分子が存在せず、膨大な無駄をしているようでも あります。発症リスクの高い、効率の悪いやり方に思えますが、どんな新型ウイルスが登場してきても、おそらく対応できるだろうという強みもあります。これが、 変 異 の激しいウイルスに対抗する最も有効な方法として、進化の過程の中で選択され、残ってきた理由と考えられます。また、最初の感染で発症するリスクを背負うことに はなりますが、一度感染して抗体ができれば、そのとき活性化されたB細胞の一部を記憶細胞として長く体内に残すことで、同じウイルスに再度感染したときにはす ぐに対 応することができ、発症を免れる、いわゆる「二度無し」あるいは「免疫がつく」ことが達成されます。これも、ウイルスとの闘いにおいて極めて有効な戦略だった はずです。
こうした生命システムの戦略は、利根川進さんが発見された当時、非常な驚きをもって迎えられました。親から譲り受けたDNAは、前回までにお話ししたよう な、DNAの損傷による望まない形での変異が起こることは知られていましたが、自らそれを変化させる仕組みがあるということは予想だにしませんでした。しか も、ランダムにエクソン を組み合わせ、偶発的な出来事である変異まで積極的に起こして改変する、というのはさらなる驚きでした。生命というのはDNAの遺伝情報に則って、整然とし たプログラムに沿って運営・管理されているというイメージがもたれていましたから、でたらめに抗体を作って「下手な鉄砲も数撃ちゃ当たる」的な戦略も取るとい う発見は、生命観に大きな変革を迫ったと受け取られたのです。(あるウイルスに抗体が結合するといった場合、抗体の方が圧倒的に小さく、結合箇所は複数ありま す。鍵と鍵穴の関係で結合しますから、場所によって異なる抗体が結合します。ランダムに作られますから、どこに結合する抗体ができるかは偶然によって決まりま す。 したがって、まったく同じDNAをもつ一卵性双生児といえども、同じウイルスに感染して必ず同じ抗体ができるというわけではないといったところから、遺伝子に よってすべてが決定論的に進むわけではないという典型例として取り上げられることもありました。ただ現在では、遺伝子決定論は違った側面からも否定されていま す。)
抗体がランダムに作られるとなると、自分のタンパク質に結合する抗体もできる可能性は十分にあります。そのため、骨髄で誕生したばかりの未熟B細胞のB細胞 受容体に何かが結合すると、そのB細胞にはアポト−シスが誘導されます。骨髄環境下では外来抗原に遭遇する確率は極めて小さいので、結合した相手は自己のタン パク質である確率 が高く、これと結合するB細胞受容体は排除しなければならないからです。また、そうした場合、L鎖遺伝子の再構成が再び起こって、自己抗原反応性を回避するメ カニズムがあることも見出されています。さらに、次回にお話しするヘルパーT細胞によるチェックも、自己のタンパク質に結合した場合、それを異物と判定しない ための重要な仕組みとなっています。
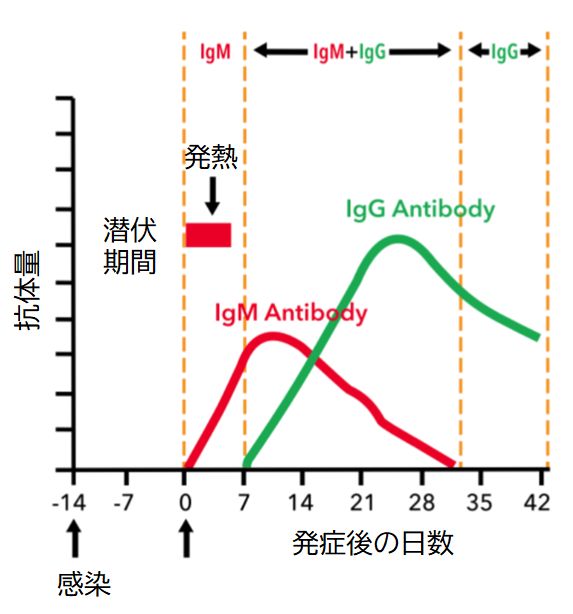
これまで定常領域は1種類であるとして話を進めてきました。しかし、H鎖の定常領域にも種類があり、それによって抗体を分類することができます。これを抗 体のクラスとよびます。感染して最初に産生されるのはB細胞表面に発現していたIgM型の抗体(M型免疫グロブリン)です。その後、抗原特異性をもつ可変領域 を保ったまま定常領域をIgM型からIgG、IgE、IgAなど他の型の定常領域に変化させ、分泌するようになります。これをクラススイッチといいます。
クラススイッチを行う理由は、定常領域がそのクラスに応じてそれぞれ特有の機能を有しているからです。例えば、IgMは初期対応の免疫グロブリンで、補体 の活性化や凝集に寄与します。多くは抗原への親和性がIgGより弱く、存在する期間も5日間程度です。その後、抗原との関係で強く活性化されるとクラススイッ チ を起こします。最も豊富に作られるのがIgGで、全抗体の8割ほどを占めます。存在する期間も7〜23日ほどと長くなり、抗原への対応にもっとも威力を発揮し ます。また、唯一胎盤を通過することができ、母体から胎児へと移動して、胎児の体のなかでも働くことができます。IgEは、寄生虫感染のとき誘導されると考え られ ていますが、寄生虫がまれな地域ではアレルギーに大きく関与するようになり、多くの現代人を悩ませています。IgAは鼻汁、唾液、母乳、腸液などに多く存在し ます。母乳に含まれるため、新生児の消化管を病原体から守っています。