今回からタンパク質の働きについて話を進めていきます。タンパク質は生命現象のあらゆる場面に関与しますから、その機能は非常に多岐にわたり ます。しかしここではそれらを 網羅的に述べるのではなく、これまでの話の流れに沿って、DNAの塩基配列、タンパク質のアミノ酸配列、そして立体構造(形)、そしてこれらがもつ “遺伝情報” に注目し て、 それを理解していただくための話題を取り上げていきます。 今回のテーマは酵素 Enzyme です。
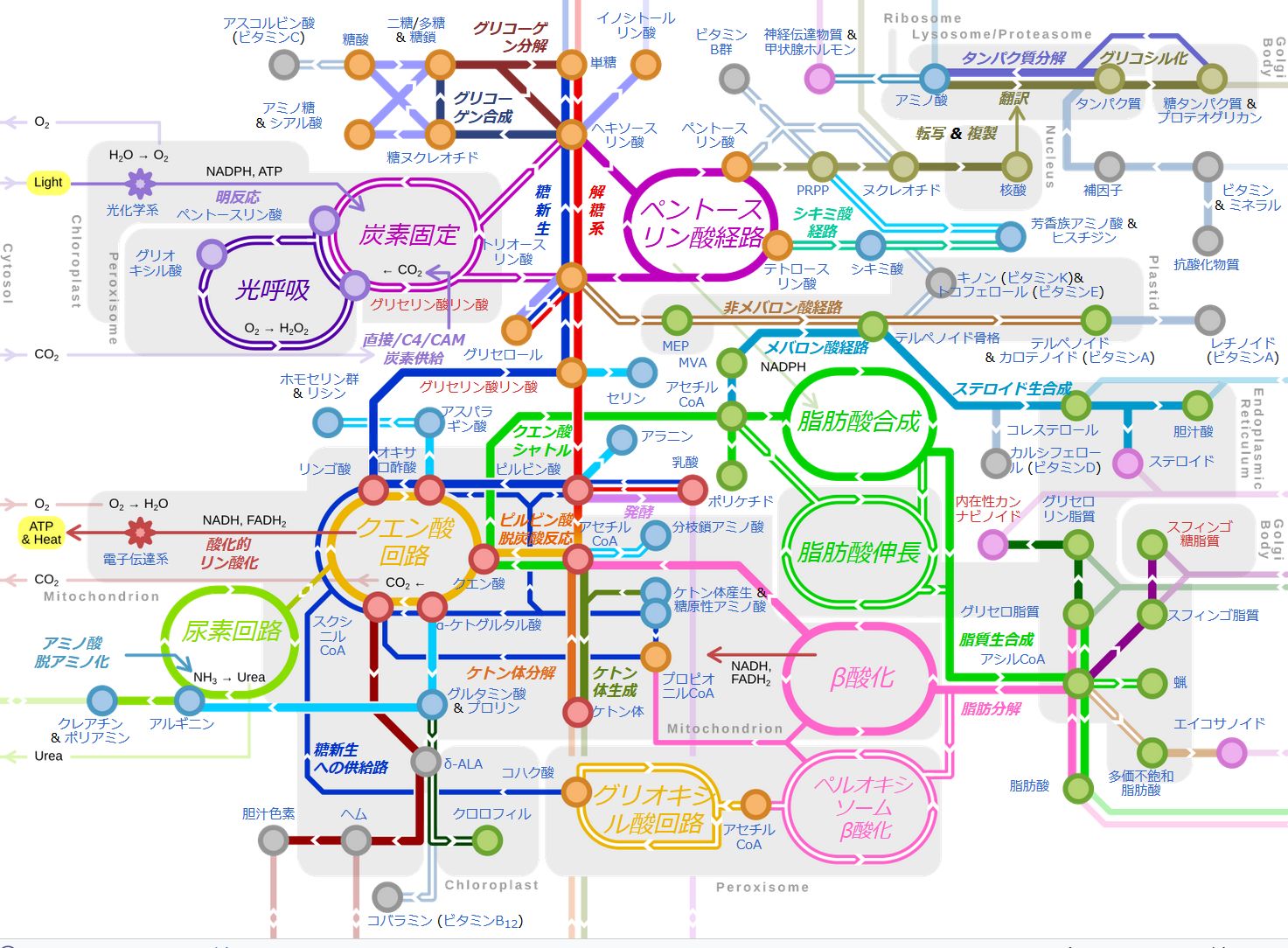
われわれの体のなかでは常にさまざまな化学反応が起こっています。図6.1は代謝経路図、あるいは生化学経路図などとよばれるもので、われわれの体の なかで起 こっているさまざまな化学反応をまとめたものの一部です。具体的な化学反応は描かれていませんが、Wikipediaのサイトに行き、この図のいろいろな場所をクリックす ると、図6.2のようなより詳細な情報を得ることが できます。そこではさまざまな化学物質名とその化学構造が散りばめられ、それらを結ぶ線が描かれています。それぞれの線は化学反応を表しています。これ まで、DNAとタンパク質ばかりに注目してきましたが、それ以外にも膨大な種類の化学物質がわれわれの体内では合成されたり、分解されたりしています。すなわ ち、さまざまな化学反応がわれわれの身体の内部では絶えず起こっているわけです。そして、図6.1や6.2から読み取れることは、そうした化学反応が壮大な ネットワークを形成し、組織化されて進行しているということです。生命とは、「高度に組織化された化学反応システム」という表現がぴったりと言えましょう。

当然のことながら、こうした化学反応が常に一斉に起こっているわけではありません。必要なときに、必要な場所で、必要な量だけ起こるようにコント ロールされています。
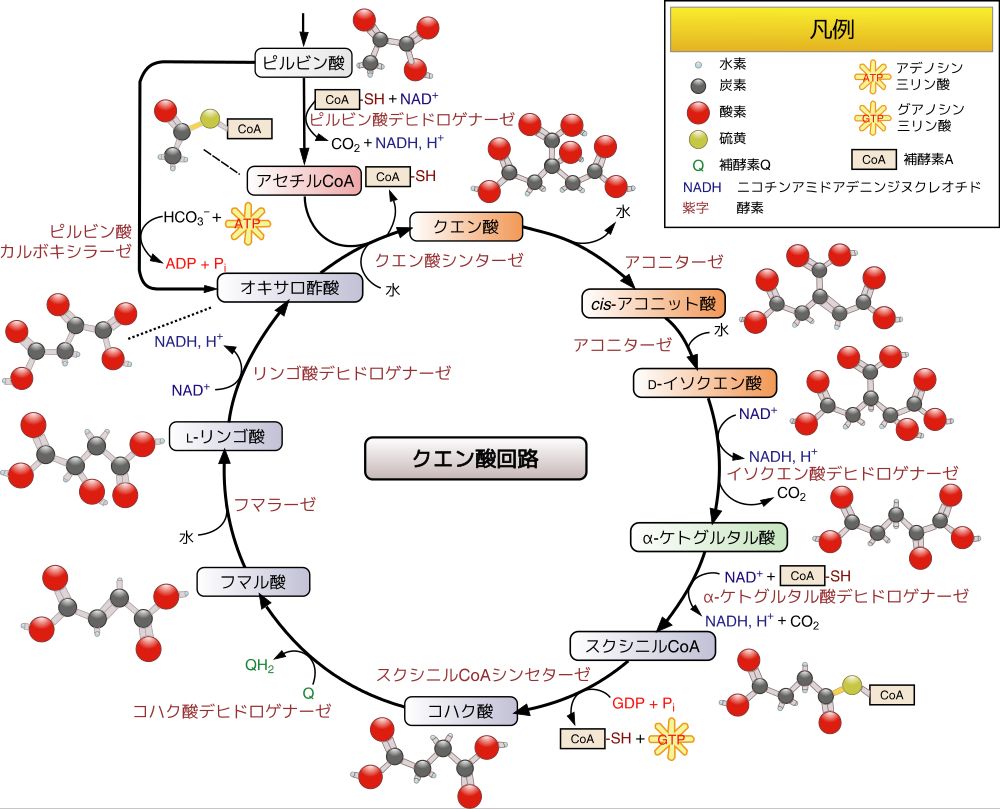
ところでみなさんは、化学の実験というと、試験管で複数の化学物質を混合し、アルコールランプなどで加熱する光景が頭に浮かぶかと思います。実は、多くの化学反応は、そ れを起こすた めには外部からある一定以上のエネルギーを供給する必要があります。この化学反応を起こすのに最低限必要なエネルギーを活性化エネルギーといいます。アルコールランプの熱 はこの 活性 化エネルギーの障壁を乗り越えるために供給しているエネルギーなのです。しかし、われわれの体では、体温という穏やかな状況でも化学反応を進行させることがで きます。それはなぜでしょうか?それは、酵素とよばれる一群のタンパク質があり、それらが活性化エネルギーの障壁を低くする機能をもつからです。こうした機 能をもつ分子は、生命現象に限らず化学工業などでも普通に見られるもので、触媒とよばれます。したがって、酵素とは、触媒機能をもったタンパク質ということが できます。ここでは触媒機能のメカニズムについては触れませんが、酵素のおかげで、われわれの体内では体をアルコールランプにかざすことなく、穏やかな条件で 化学反応を進行させることが可能なのです。
このことはまた、生体内では、それぞれの化学反応は酵素なしには起こらないことも意味しています。すなわち、必要なときに、必要な場所で、必要な量だけある化学物質を作 るということ は、酵素そのものを合成する、しないでコントロールできることを意味しています。酵素はタンパク質です。したがって、DNAからRNAへの転写、RNAからタンパク質 への翻訳という過程を経て合成されます。すなわち、転写を調節することで、すなわち酵素の生合成をコントロールすることで化学反応がコントロールできること になります。この転写調節は生命にとって非常 に重要な作業の一つです。しかし、とりあえずここでは触れないこととし(第11回の講義で話す予定です)、まずは酵素についてさらに詳しく見ていくことにします。
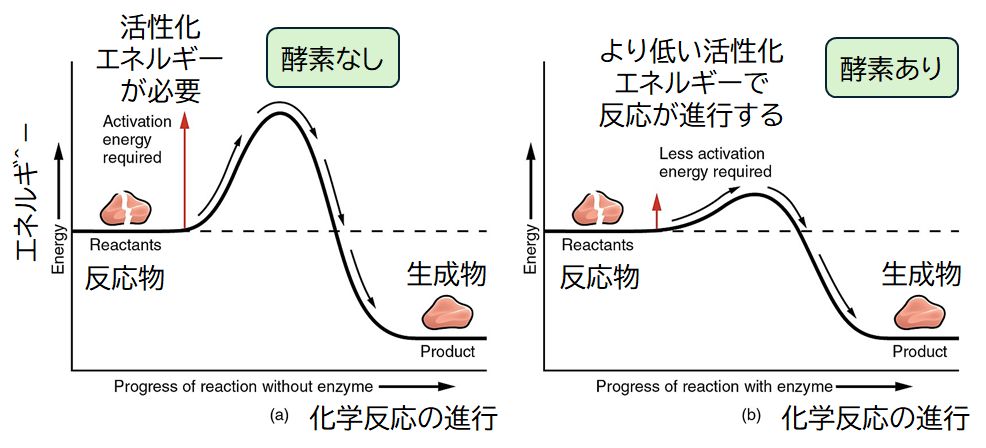
図6.4に分子AとBが分子Cに変化する化学反応を酵素が触媒する酵素反応の流れを模式的に示しました。変化前の分子AとBを基質、変化後の分子Cを生成物といいます。 酵素はまず分子A および B と結合して複合体を形成します。そこで A+B → C の化学反応の活性化エネルギー障壁を下げるように機能し、この化学反応が進行するのを手助けします。分子 C がで きるとこれを放出し、酵素はもとのフリーな状態へと戻り、新たに基質と結合し、同じプロセスを基質がなくなるまで繰り返します。
図6.4 酵素反応の模式図
ところで、図6.1、6.2で示したように、われわれの体内ではさまざまな化学反応が起こります。しかし、そのすべての化学反応を1つの酵素が担当してい るというわけ ではありません。基本的には、それぞれの化学反応に対して、それ専属の酵素が存在します。図6.2では、化学反応を示す矢印の横に何やら名前が書かれています が、それがその化学反応を触媒する酵素の名前なのです。化学反応ごとに異なる名前が書かれていることに注目してください。また、これらのことは、われわれの体 には非常にたくさんの種類の酵素が存在するということでもあります。
それでは、そうしたいろいろな酵素がそれぞれ、自分が対応する化学反応、ある いは基質をどのように認識するかが問題となります。そのメカニズムを的確に、そして視覚的に表現したのが「鍵と鍵穴モデル」です。あるタンパク質が特定の化学物質だけに作 用することを、タ ンパク質の基質特異性と言いますが、その「特異性」をもっとも的確にこのモデルは表現しており、この講義ではもっとも重要なキーワードの一つです。
(注)特異性という用語は生命科学の分野では頻繁に使われます。英語では specificationで、むしろ「特定のものを指定する」という方がわかりやすい気もしますが、すでに専門用語として定着していますので、ここでもこの用語を用いる ことにします。特異性は、「遺伝情報とは何か」を考えていくうえでもっとも重要な概念の一つで す。この講義では「鍵と鍵穴モデル」という言葉を頻繁に使いますが、これはむしろ特異性という言葉で表現した方が、より的確でスマートな表現となるとは思うのですが、視覚 的にイ メージしやすい「鍵と鍵穴モデル」を使わせていただく場面が多いと思います。
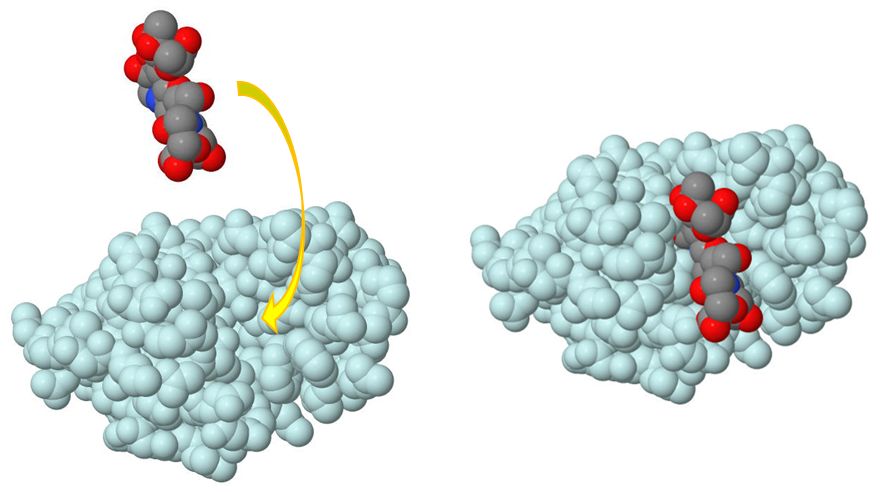
第3回の講義で、タンパク質はそれぞれ固有の立体構造(形)をとる、という話しをしました。酵素も、当然のことながら、それぞれが固有の立体構造をもっています。一般 に、図 6.4に示したような窪みが存在するのが特徴で、その形が酵素ごとに異なるのです。そして、この窪みの形と対応する基質の形が、 ちょうど鍵と鍵穴のようにぴったり合うとき、すなわ ち相補的であるとき、酵素と基質は結合することができるというわけです。実際には、形の相補性だけでなく、その接触面での物理・化学的な相互作用が適合することが必要で す。しかし、概念的には、そうしたことも含めて鍵と鍵穴のイメージで捉えることにし、これを酵素と基質の結合に関する「鍵と鍵穴モデル」とよびま す(酵素Aは基質Bに、あるいは基質Bは酵素Aに特異的に結合すると表現することもできます)。ち なみに、酵素のこの鍵穴部分を活性部位とよびます。この領域で、酵素と基質の相互作用を通して化学反応が進行するからです。
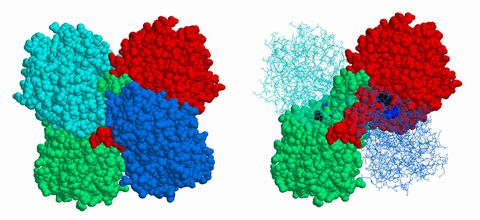
図6.4は漫画的表現ですが、実際のタンパク質のデータからCGで描かれたものを図6.5に示しました。各球は原子を表しています。左の酵素分子の中央に 窪みが見えますが、そこに基質分子が結合したのが右の図です。鍵と鍵穴の関係が成り立っている感じが分かっていただけたでしょうか。 それぞれの酵素は生体内でさまざまな分子に出会うわけですが、互いに相補的であるときのみ特異的に結合し、図6.4の図式が進行するわけです。こうしたプロセスに対して、 酵素に目があるわけでも、意思があるわけではないのですが、分子認識 molecular recognition という擬人的な表現も好んで使われます。
鍵と鍵穴モデルが成り立つ性質、あるいは基質特異性は酵素だけに限ったことではありません。多くのタンパク質が示す重要な性質です。この講義では、この性 質に特に注目しながら生命というシステムを眺めていこうと思っています。
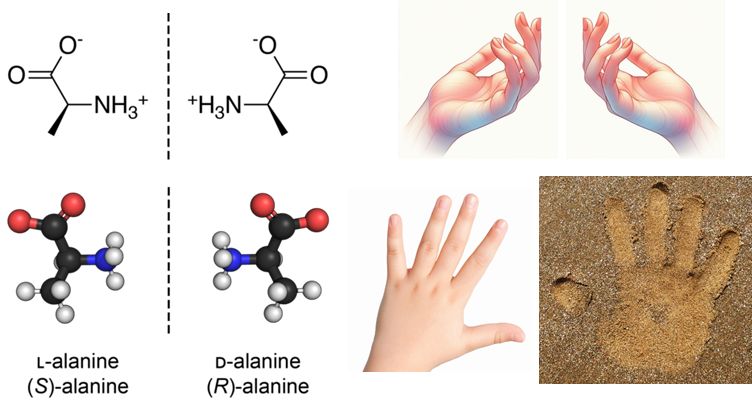
鍵と鍵穴モデルによって起こる現象を理解するための例として、鏡像関係にある分子の話をしましょう。図6.6に示すように、分子のなかには、ちょうど右手 と左手の関係のように、その立体構造が互いに鏡像関係にある分子(キラリティーをもつ分子)がたくさんあります。鏡像関係にある分子は、化学構造はまったく同 じで、化学的な性質もまったく同じであるにもかかわらず、生物学的にはその機能が異なるものが数多くあります。それは、これらの分子と相互作用するタンパ ク質(必ずしも酵素ではない)との関係を考えると、一方の分子が鍵と鍵穴の関係にあっても、鏡像関係にあるもう一方の分子は鍵と鍵穴の関係にはならないからで す。たとえば、砂に右手の手形の窪みを作っても、その窪みに左手はフィットしないのと同じです。
もう一つ酵素に関する身近な例としてお酒にまつわるお話をしましょう。まずはエチルアルコールとメチルアルコールについてです。
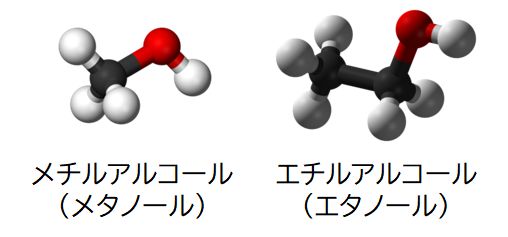
アルコールにはいろいろな種類があるのですが、みなさんが飲むお酒に含まれているのはエチルアルコール(あるいはエタノール)です。エチルアルコールは体内にはいると、 アルコール脱水素酵素によってアセトアルデヒド に変わります。ここで、エチルアルコールが基質、アセトアルデヒドが生成物であり、エチルアルコールとアルコール脱水素酵素が鍵と鍵穴の関係にあります。
ところで、メチルアルコール(あるいはメタノール)というアルコールがあります。図6.7に示したように両者の化学構造はよく似ています。
そのため、メチルアルコールもアル コール脱水素酵素と鍵と鍵穴の関係が成り立ち、ホルムアルデヒドという生成物が産生されます。ところが、このホルムアルデヒドは強い毒性をもつため、メチルアル コールを飲むと中毒症状を呈します。第二次大戦後の日本では、お酒がないために、同じアルコールだからとメチルアルコールを飲む人たちがいて、失明したり死亡 し たりした事件が多発しました。ちなみに、メチルアルコールを誤って摂取したときは、アルコール脱水素酵素により親和性の高いエチルアルコールを投与するのが有 効である、と日本中毒学会のホームページには書かれています。やはり、鍵と鍵穴の関係は本来の基質の方がより強く成り立っているということでしょう。
酵素と基質の鍵と鍵穴の関係がどの程度厳密に成り立っているかは酵素により異なります。少なくともメチルアルコールに関しては、進化の過程で飲む可能性は ありませんでしたから、この2種類のアルコールを厳密に区別するだけの厳密な鍵と鍵穴の関係を築く必要はなかったということでしょう。
お酒のアルコール(今後はエチルアルコールを単にアルコールとよぶことにします)は、脳に作用して酔いの心地よさを引き起こします。しかし、アルコール脱 水素酵素によっ て生成されたアセトアルデヒドには軽い毒性があり、赤面、頭痛、悪酔いといった症状が出てきます。しかし、アセトアルデヒドを基質とするアルデヒド脱水素酵素 が酢酸へと変化させ、さらにその後、水、二酸化酸素へと変化して呼気とともに体外に排出されると酔いは冷めていきます。そこで、この2つの酵素の話をします が、特にここでは、その多型(個人差)に注目した話題を取り上げたいと思います。
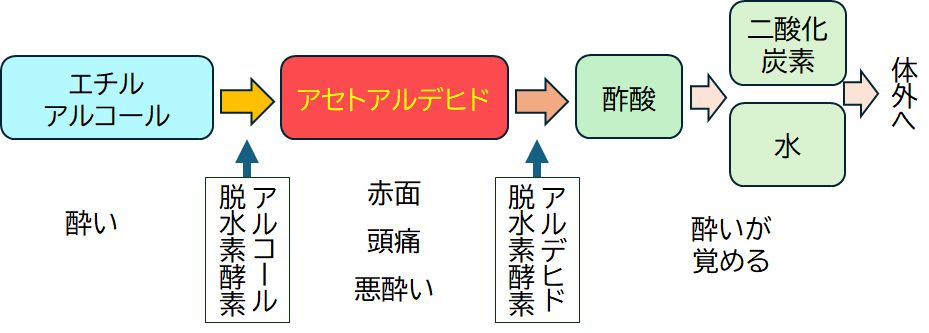
図6.8 エチルアルコールの分解。アルコール脱水素酵素とアルデヒド脱水素酵素の役割
アルコール脱水素酵素とアルデヒド脱水素酵素はいずれもすでにDNAの塩基配列、タンパク質のアミノ酸配列がわかっています。ここでは、アルデヒド脱水素 酵素(ALDH2)を例にお話しします。実は、この酵素には2つの型があることが知られています。それらはALDH2*1、ALDH2*2 と表記されますが、その塩基配列の最後の部分を以下に示しました。(全配列に興味のある方は こ ちら をご覧ください)
アルデヒド脱水素酵素2 ALDH2*1 高活性型1561 ggcatacact gaagtgaaaa ctgtcacagt caaagtgcct cagaagaact cataagaatc 501 ..A..Y..T. .E..V..K.. T..V..T..V ..K..V..P. .Q..K..N.. S. 517アルデヒド脱水素酵素2 ALDH2*2 低活性型
1561 ggcatacact aaagtgaaaa ctgtcacagt caaagtgcct cagaagaact cataagaatc 501 ..A..Y..T. .K..V..K.. T..V..T..V ..K..V..P. .Q..K..N.. S. 517
上の行が塩基配列、下の行がそれに対応するアミノ酸配列。見やすいように、塩基配列は
10塩基ごとに空白を入れている。最初の数字は、最初の塩基およびアミノ酸の通し番号。
タンパク質は517個のアミノ酸からなり、ここでは一番最後の部分が示されている。
上段の塩基配列で赤で示した部分に gaa というコドンがあります。これは E というアミノ酸 (グルタミン酸) に対応するコドンです。しかし下段の塩基配列では、g が a に置換され aaa というコドンに変わり、対応するアミノさんが K(リジン)に変わっています。この酵素は全部で517個のアミノ酸からなるのですが、この1つのアミノ酸 が違うだけで、後者は前者より活性が低くなります。すなわち、アセトアルデヒドを 酢酸へと変化させる触媒能力が低いのです。そうすると何が起こるかというと、アセトアルデヒドが体内に滞留する時間が長くなり、結果、赤面、頭痛、悪酔 いといった症状が出てきます。体質的に酒に強い人と弱い人がいますが、まさにこれがそれを決めている主要な遺伝子の一つなのです。たった一つの塩基の違い(これをSNPと よぶことは第5回目の講義で学びました)がその人の体質に影響を与える典型的な例をこれに見ることができます。(ちなみに、g が祖先型、a が変異型であることがわかっています)
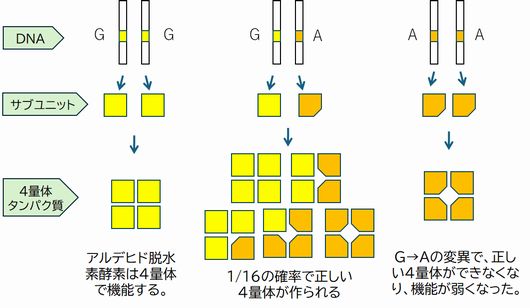
ところで、われわれは父親と母親からそれぞれDNAを引き継ぎますから、この酵素の遺伝子を2つもっています。したがって、SNP部分で活性型、不活性型 を表すと、GG、 AG、AAの3つのタイプがあることがわかります(ここからは塩基を大文字で表します)。GGは活性が高く、AAは活性が低いのですが、AGはどちらかといえば活性が低 く、しかしAAよりは高いと いう状況で、酒は弱い方に分類されます。これは次のような事情によります。 実は、アルデヒド脱水素酵素は遺伝子から作られたタンパク質が4つ合体して初めて機能を発揮できます(図6.9)。こうしたとき、一つ一つのタンパク質はサブユニットとよ ば れ、4 つ合体したもの(4量体とよぶ)をタンパク質と言い換えます。G→Aの変異が起こったとき、アミノ酸はE→Kと変化しますが、この変化によって、4量体が不安 定になります。このアミノ酸 E はサブユニットどうしの接触面に位置しているのですが、Kに変わることで安定な接触が保たれなくなり、機能が低下するわけです。ただ し、遺伝子型がAGの人は、1/16 の確率で活性の高い4量体ができますので、AAの人よりはアセトアルデヒドの分解効率は高くなります。しかしGGの人に比 べれば、かなりお酒に弱いということになります。
121 cctcctaagg cttatgaagt tcgcattaag atggtggctg taggaatctg tcgcacagat 31 .P..P..K.. A..Y..E..V ..R..I..K. .M..V..A.. V..G..I..C ..R..T..D.アルコール脱水素酵素1B ADH1B*2 高活性型
121 cctcctaagg cttatgaagt tcgcattaag atggtggctg taggaatctg tcacacagat 31 .P..P..K.. A..Y..E..V ..R..I..K. .M..V..A.. V..G..I..C ..H..T..D.
すなわち、アルコールを分解する速度が後者の方が 高いことになります。お酒を飲んで、気持ちよく酔っぱらうことができるのはアルコールの作用です。したがって、活性型AAのアルコール脱水酵素をもつ人は、低 活性型の人より体内にアルコールが滞留する時間が短く、酔いにくいということになります。それに加えてアルデヒド脱水素酵素の活性が高い人は、アセトアル デヒドの体内残留時間も短くなりますから 不快な症状もありません。いわゆる酒に強い体質ということになります。ところが、アルデヒド脱水素酵素の活性が低いと悲惨です。アセトアルデヒドの体内残留時 間が長くなり、より不快な症状が出てくる可能性が高くなります。
表1には、日本人について、これらの遺伝子型の頻度が示してあります。アルデヒド脱水素酵素については、(GG)と(AG+AA)の割合がほぼ半々である ことがわかります。このことは、欧米やアフリカと大きく異なる点です(このページ最後の付録「高活性型アルコール脱水素酵素、低活性型アルデヒド脱水素酵素を もつ人 の割合の地域差」参照)。

表1.日本人のアルコール脱水素酵素およびアルデヒド脱水素酵素の活性型・低活性型の頻度
((株)アサヒビール調べ)
| アルコール脱水素酵素 | ||||
|
ADH1B *1 / *1
GG 低活性 |
ADH1B *1 / *2 AG 活性 |
ADH1B *2 / *2 AA 高活性 |
||
|
アルデヒド
脱水素酵素
|
ALDH2 *1 / *1 GG 活性 |
A 2% |
B 14% |
B
33%
|
| ALDH2 *1 / *2 AG 低活性 |
C 2% |
D 13% |
D
27%
|
|
| ALDH2 *2 / *2 AA 不活性 |
E 0.004% |
E
2%
|
E
5%
|
|
A 《最もアルコール依存症になりやすいタイプ》アル コールからアルデヒドへの分解が遅く、アルデ ヒドから酢酸への分解が速いため、アルコールが体内に長く とどまり、気持ちよく酔え、不快な症状も起きにくい。そのためお酒好きになりやすく、アルコール依存症になりやすい。
B 《お酒にやたら強いタイプ》アルコールからアルデヒ ド、アルデヒドから酢酸への分解がどちらも速いため、あまり酔わず、不快にもならない、きわめてお酒に強いタイプ。
C 《お酒に強いと勘違いしやすいタイプ》アルコールか らアルデヒド、アルデヒドから酢酸への分解がどちらも遅いため、酔いやすく、お酒を好きになりやす い。しかし、適量を超えると不快な症状が起こり、二日酔いにもなりやすい。
D 《顔がすぐに赤くなるタイプ》アルコールからアルデ ヒドへの分解が速く、アルデヒドから酢酸へ の分解が遅いため、少量の飲酒でもアルデヒドがすぐに産生され、しかも長く体内にとどまるため、顔が赤くなり、吐き気などの不快な症状が起きやすい。
E 《下戸タイプ》アルデヒドが分解できないため、ごく 少量のアルコールでも顔面紅潮、眠気、動悸、吐き気などの不快な症状が起きやすい。
今回は酵素についてお話ししました。今後、鍵と鍵穴モデルが執拗に出てきます。タンパク質の立体構造が情報をもつという視点は、生命をDNAとタンパク質からなるシステ ムと考え、理解していく上でもっとも重要なものの一つであるからです。前回までの繰り返しになりますが、親から子へとDNAが渡されます。DNAは塩基配列と いう形でタンパク質のアミノ酸配列の情報をもち、アミノ酸配列がタンパク質の立体構造の情報をもちます。すなわち、DNAはタンパク質の立体構造の情報を子に 伝えているのです。その立体構造が「情報」であるという見方を、今後の話題のなかでより深く理解していただきたいと思っています。
![]()
高活性型アルコール脱水素酵素、低活性型アルデヒド脱水素酵素をもつ人 の割合の地域差