私たちの体は成長と修復のため安定したアミノ酸の供給を必要としています。そのため、毎日タンパク質を摂取することが必要です。しかし、タンパク質は、そ の ままでは腸から吸収することはできません。酵素を使ってその構成単位であるアミノ酸にまで消化する必要があり、そのためのいくつもの酵素を用意しています。
私たちが食事で摂取した大豆・魚・肉などに含まれるタンパク質の分解(消化)は、胃から始まります。タンパク質はまず胃酸によって変性を受け、さらに、タ ンパク質分解酵素(プロテアーゼ)の一種である消化酵素ペプシンによって大雑把に分解されます。ある程度胃で消化されたタンパク質は、さらに、すい臓から十二 指腸に分泌されて活性化したトリプシンなどの消化酵素によって1個のアミノ酸、あるいは2個か3個のアミノ酸でできた小さいペプチドの状態にまで分解され、小 腸 の粘膜上皮細胞から吸収され、われわれの遺伝子が指定するアミノ酸配列をもったタンパク質が生合成されます。
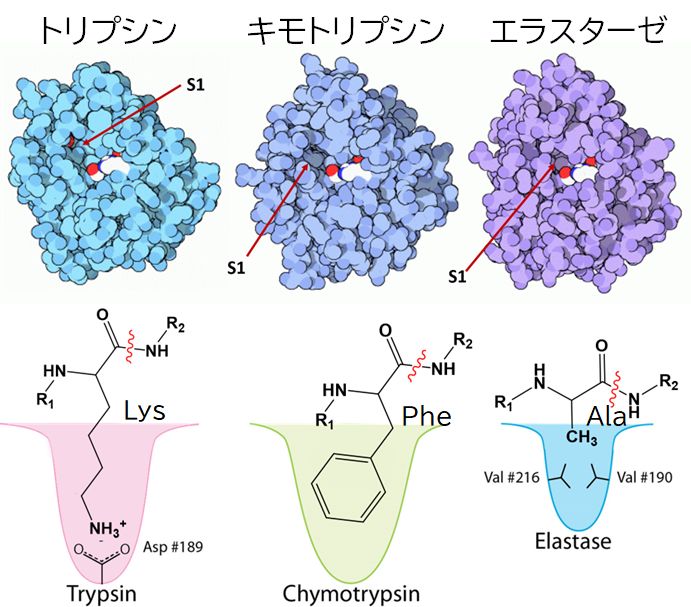
トリプシン(trypsin)はタンパク質切断反応においてアミノ酸セリン(Ser)を用いることから、セリンプロテアーゼとして知られています。セリン プロテアーゼにはト リプシンの他にもキモトリプシン(chymotrypsin)、エラスターゼ(elastase)などさまざまな酵素があり、どれも似たようなメカニズムでタ ンパク質を切断しますが、それぞれペプチド鎖の特有の部分の切断を受けもっています。トリプシンは塩基性アミノ酸であるリジンあるいはアルギニンの隣を、キモ トリプシンはフェニルアラニンなどの芳香環をもつ疎水性の大きなアミノ酸の隣を、そしてエラスターゼは、グリシン、アラニン、バリンのような小さ な疎水性アミノ酸の隣を切断します。
こうしたアミノ酸の違いを認識できるのは、これらタンパク質にあるS1ポケットと呼ばれる結合部位の形状、そこに存在するアミノ酸の物理化学的特性が、そ れぞれが対応するアミノ酸とその形状や相互作用において適合するからです。

図1 (上)トリプシン、キモトリプシン、エラスターゼの立体構造を空間充填モデルで表現した。基質が結合するS1ポケットが示されている。 (下)S1ポケットの概略図。トリプシンでは、ポケットの底部に、基質の塩基性アミノ酸と静電相互作用する酸性アミノ酸 Asp(アスパラギン酸)が配置されている。キモト リプシンでは、大きな疎水性アミノ酸が入れるように大きなポケットを形成している。そしてエラスターゼでは、小さな疎水性アミノ酸が基質となるため、それと 疎水性相互作用するようにポケット側には小さな疎水性アミノ酸 Val(バリン)が2つ配置されている。
ところで、体内にあるタンパク質を切断する酵素を作る時には最新の注意が必要です。もし、細胞の内部で活性がある状態で合成されると、細胞にある自らのタ ンパク 質が分解され、細胞がダメージを受けてしまうからです。それを回避するため、酵素を不活性な型(これを酵素前駆体と呼ぶ)で作っておき、その後腸内で活性化するという ことが行われます。トリプシンでは、最初余分なペプチド鎖をつけて作られます。この余分な部分がついたトリプシンはトリプシノーゲンと 呼ばれる不活性型で、タンパク質鎖を切断することはできません。これが腸に入ると、エンテロペプチダーゼという酵素によってその余分な部分が切断され、活性型の酵素になり ま す。
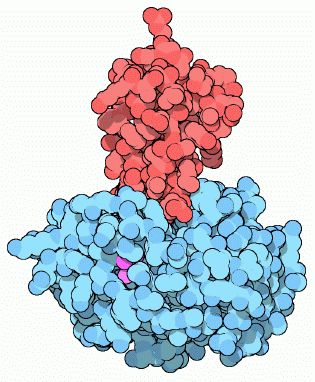
更に保険として、膵臓も小さなタンパク質トリプシン阻害タンパク質(図2の赤色部分)を作ります。これは、腸に分泌される前に存在するどんな微量の活性型 ト リプシンでも結合して、その活性を阻止します。これはトリプシンの活性部位に結合して、その活性を阻害しますが、この阻害剤自体は切断されることはありませ ん。 こ こでも、トリプシンの活性部位と阻害タンパク質が鍵と鍵穴の関係で結合していることがわかると思います。