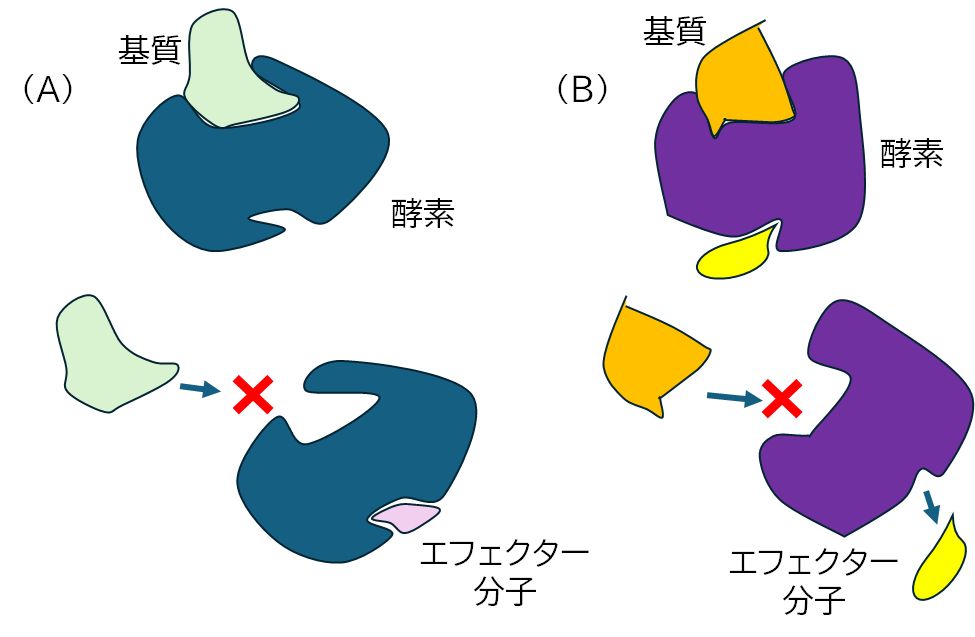
図1 アロステリック効果を利用して酵素活性のON/OFFをエフェクター分子によって制御する様子を
示した概念図。エフェクター分子が存在し、酵素に結合することで基質の結合部位の形が変わり、
(A)では基質が結合できなくなった、(B)では基質が結合できるようになったことを示している。
アロステリック効果とは、タンパク質に、基質とは異なるエフェクターと呼ばれる分子が結合することでその形が変化し、その機能に何らかの変化 が生じることをいいます。たとえば、活性部位の形が基質が結合できるように変化したり、あるいは結合できなくなるように変化したりすることで、酵素活性の ON/OFFを制御する現象や、複数のサブユニットからなるタンパク質で、サブユニットの形の変化が協同的に起こり、タンパク質全体が示す活性が制御される現象 などが知られています。前者については、図1にその概略を示しました。後者については、ヘモグロビンの酸素吸着に関する機能の制御が、アロステリック効果を説 明 するときのもっとも教科書的な話題ですので、以下に紹介したいと思います。
アロステリック allosteric は、ギリシャ語のallos: 他の、stereos: 立体あるいは形 から派生した語で、「他の形」といった意味

図1 アロステリック効果を利用して酵素活性のON/OFFをエフェクター分子によって制御する様子を
示した概念図。エフェクター分子が存在し、酵素に結合することで基質の結合部位の形が変わり、
(A)では基質が結合できなくなった、(B)では基質が結合できるようになったことを示している。
生物が身体を動かすエネルギーを作るために必要な要素の1つに酸素があります。この酸素を肺で体内に取り込み、細胞で消費し、老廃物となる二酸化炭素を体 外へと排出する仕組みが呼吸です。そして、肺で酸素を受け取り、筋肉などの末梢組織に運んでいるのが血液中の赤血球というわけですが、そこで実質的に働いてい るのが赤血球の重量の約3分の1を占めるヘモグロビンというタンパク質です。
ヘモグロビンは、α鎖とβ鎖と呼ばれる2種類のポリペプチド鎖(サブユニットとよぶ)2本ずつ、計4本からなるタンパク質で、各々のサブユニットは、鉄を
含 む
ヘムと呼ばれる分子を1つずつ含有しています。酸素はこのヘムの中にある鉄と結合し、組織へと運ばれていきます。余談ですが、赤血球の赤い色はこのヘモグロビンに
含まれる鉄が酸素と結合したときに発する色なのです。
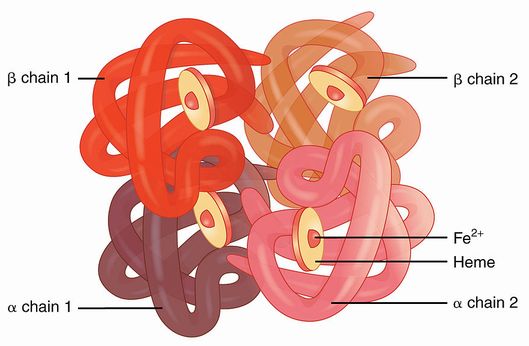
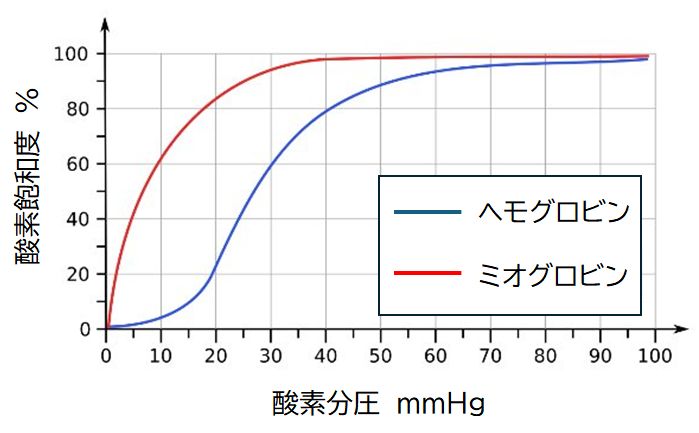
図2 (左)ヘモグロビンの立体構造。4つのサブユニットからなる。サブユニットにはそれぞれ
中央に鉄を含むヘムがあり、ここに酸素が吸着する。(右)酸素分圧の変化にともなう酸素吸着の
割合の変化。ヘモグロビンとミオグロビンの場合を対比しながら示している。
ヘモグロビンは、血中の酸素分圧(酸素量と思ってください)の高いところ(肺)で酸素と結合し、低いところ(末梢組織)で酸素を放出することがその機能で すが、このとき、肺ではできるだけ多くの酸素と結合し、各末梢組織では、できるだけ多くの酸素を解離することが望ましいわけです。それをいかに行っているか が、ここ で話題としているアロステリック効果と関連しているというわけです。
このことを理解するためには、ヘモグロビンとよく似たタンパク質、ミオグロビンと比較対照しながら見ていくことがわかりやすいかと思います。ミオグロビン は、ヘモグロビンから受け取った酸素を蓄えることがその機能なのですが、ヘモグロビンと大きく異なる点は、ヘモグロビンが4つのサブユニットからなるのに対し て、1つのサブユニットに相当する部分だけからなるタンパク質だということです。そして、図に示しましたように、まわりの酸素量に比例して酸素が吸着し、酸素 分圧が低いところでもそれなりに酸素が吸着しています。酸素を蓄えることが主たる機能ですから、それが理にかなっていることになりますが、ヘモグロビンと同じ 役割 を託そうと思うと、酸素分圧が低い末梢組織でもなかなか酸素を解離してくれないわけですから、酸素運搬という側面からはヘモグロビンよりも劣るということになり ます。
一方、ヘモグロビンの酸素の吸着の様子を見ると(図2右)、酸素分圧が低いときにはあまり酸素が吸着せず、ある程度の濃度になると、急激に酸素を吸着する ようになります。その曲線はS字型(シグモイド曲線と呼びます)をしているのが特徴です。シグモイド曲線は、酸素分圧に応じて、緩やかなON/OFFを実現し ていることを意味します。
ミオグロビンとヘモグロビンのこの違いは、ヘモグロビンが4つのサブユニットからなる点にあります。その仕組みを説明するモデルはいくつかあるのですが、 ここではアロステリック効果を最も直感的に理解しやすい Koshland-Nemethy-Filmer モデルで説明したいと思います。
ヘモグロビンの各サブユニットは、RとTと呼ばれる2つの形をとることが知られています。酸素が吸着していない状態ではサブユニットはT状態にあり、結合 するとR状態に変わります。一方、サブユニット間には相互作用があり、T状態どうしの相互作用、R状態どうしの相互作用は構造の安定化に寄与するのですが、R 状態のサブユニットとT状態のサブユニット間の相互作用は構造を不安定化させます。
こうした前提で、酸素分圧の変化にともなうヘモグロビンの変化を考えてみましょう(図3)。酸素分圧が小さいとき、サブユニットはT状態にあります。酸素
がときおりサブユニットのどれかに吸着すると、そのサブユニットはR状態に移行します。しかしサブユニット間の相互作用が不安定化するため、酸素を解離し、再
びT状態へと戻ります。一方、酸素量がある程度上昇すると、すべてのサブユニットに酸素が吸着する確率が高まり、ひとたび全部に酸素が吸着するとすべてが一斉
にR状態となります。こうなると、構造が安定化し、酸素を解離しないようになります。こうして、酸素分圧に対する酸素吸着の割合はシグモイド曲線となるので
す。
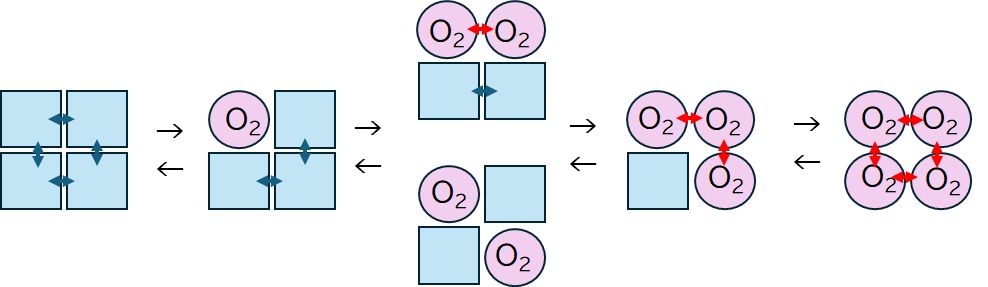
図3 ヘモグロビンの酸素吸着におけるアロステリック効果を説明するモデル。
サブユニットがT状態、あるいはR状態にあることをそれぞれ四角と丸で示している。
酸素が少ないときは左端の状態、酸素がある程度以上ある場合には右端の状態が安定
であり、中間状態は比較的不安定であると、酸素吸着曲線はシグモイド型となる。
このように、4つのサブユニットの相互作用によって起こる現象は協同現象とよばれます。たとえば、
水と氷は0℃で相転移を起こしますが、これなど協同現象の典型です。すべての水分子が氷の状態になるか、あるいは液体の水の状態になるかが安定な状態であり、
一 部
水、一部氷という混在した状態が不安定なため起こるわけですが、ヘモグロビンと異なるのは、膨大な数の水分子がそれに関与することで、その場合、0℃という温度で一斉に氷
から水、あるいは水から氷という構造の劇的な変化が実現されるのです。