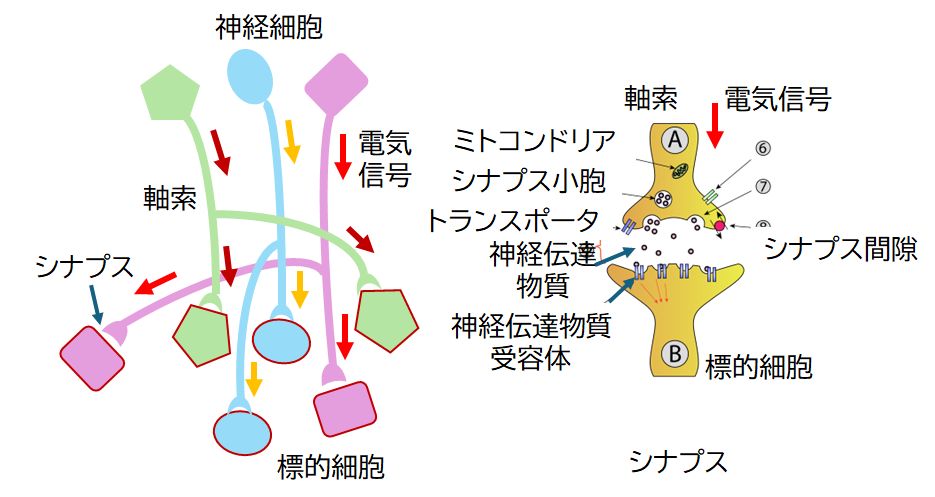
丂慜夞偼儂儖儌儞庴梕懱僞儞僷僋幙偺榖傪偟傑偟偨偑丄崱夞偼丄恄宱揱払暔幙庴梕懱僞儞僷僋幙偺榖傪偟傑偡丅懡嵶朎惗暔偱偼丄嵶朎娫偱僐儈儏僯働乕僔儑儞傪庢傝偁偆偙偲偑昁 梫晄 壜寚偱偡丅儂儖儌儞偲 儂儖儌儞庴梕懱偺宯偱偼丄棧傟偰懚嵼偡傞暘斿嵶朎偲昗揑嵶朎偑寣塼傪捠偟偰僐儈儏僯働乕僔儑儞傪庢傝傑偟偨偑丄崱夞偺僥乕儅偱偁傞恄宱宯偱偼丄恄宱嵶朎偑幉嶕 偲偄偆嵶挿偄榬傪捈愙昗揑嵶朎偵傑偱怢偽偟偰僐儈儏働乕僔儑儞傪庢傝傑偡乮恾10.1乯丅偟偨偑偭偰丄恄宱宯偱偼弖帪偵僐儈儏僯働乕僔儑儞傪庢傟傞偺偑摿挜偱 偡丅

丂恄宱宯偼丄嵟傕暋嶨偐偮崅搙偵慻怐壔偝傟偨惗懱撪偺僔僗僥儉偱偡丅偨偲偊偽姶妎婍姱偐傜庴偗庢偭偨忣曬偼擼傊偲揱偊傜傟丄擼偱忣曬張棟傪偟偨屻丄偦偺墳摎偺偨 傔偺巜椷傪塣摦婍姱傪偼偠傔丄偝傑偞傑側婍姱偵憲傝傑偡丅擼偱偼恄宱嵶朎偑暋嶨側僱僢僩儚乕僋傪峔抸偟偰偍傝丄偁傞恄宱嵶朎偑嫽暠偡傞偲乮妶摦揹埵傪敪惗偡傞 偙 偲傪偙偆傛傃傑偡乯丄偦傟偑懠偺恄宱嵶朎傪嫽暠偝偣丄偦傟偑偝傜偵懠偺恄宱嵶朎傪嫽暠偝偣傞偲偄偭偨嫽暠偺楢嵔傪堷偒婲偙偡偙偲偱丄暋嶨側忣曬張棟傪峴偭偰偄 傑偡丅
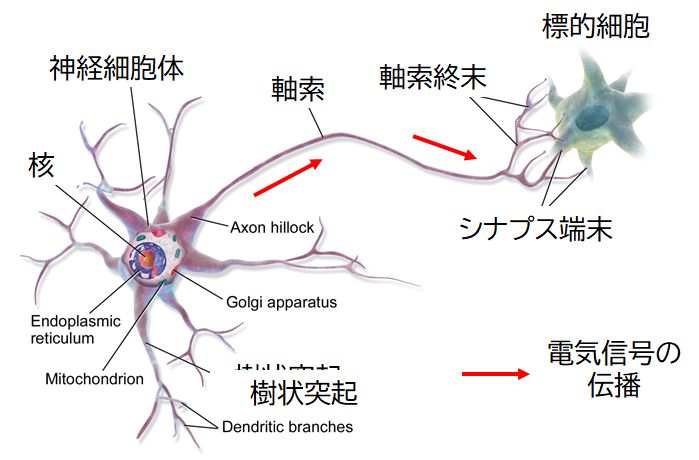
丂恄宱宯偺婎杮扨埵偼恄宱嵶朎乮僯儏乕儘儞乯偱偡丅恾10.2偵僯儏乕儘儞偺峔憿傪帵偟傑偟偨丅僯儏乕儘儞偼丄挿偔怢傃偨侾杮偺幉嶕偲丄斾妑揑抁偔偰巬暘偐傟偟偨懡 偔偺庽忬撍婲傪傕偮嵶朎懱偲偐傜側傝傑偡丅僯儏乕儘儞偺嫽暠偼丄幉嶕傪宱偰丄棧傟偨偲偙傠偵偁傞暿偺僯儏乕儘儞傗嬝擏嵶朎偵揱傢傝傑偡丅幉嶕偺挿偝偼侾噊埲壓 偺傕偺偐傜丄侾倣偵媦傇傕偺傑偱偁傝傑偡丅僯儏乕儘儞偺嫽暠丄偡側傢偪妶摦揹埵偑幉嶕忋傪揱傢傞偙偲傪揱摫偲偄偄傑偡丅
丂幉嶕忋偺嵶朎枌偵偼Na+僠儍儞僱儖乮僫僩儕僂儉僀僆儞僠儍儞僱儖乯偲K+僠儍儞僱儖乮僇儕僂儉僀僆儞 僠儍儞僱儖乯偲傛偽傟傞僞儞僷僋幙偑暲傫偱偄傑偡丅Na+僠儍儞僱儖丄K+僠儍儞僱儖偲偼丄Na+僀 僆儞偩偗丄偁傞偄偼K+僀僆儞偩偗傪慖戰揑偵捠偡偙偲偺偱偒傞僞儞僷僋幙偱丄偙傟傜偺嫟摨嶌嬈偱幉嶕忋傪妶摦揹 埵偑揱攄偟偰偄偔偙偲偑偱偒傑偡丅偦偺儊僇僯僘儉偺愢柧偼寢峔栵夘側偺偱丄Na+僠儍儞僱儖偵拲栚偟偰戝嶨攃 偵愢柧偟傑偡乮恾10.3乯丅Na+僠儍 儞僱儖偵偼奐 忬懺丄暵忬懺丄晄妶壔忬懺偲偄偆俁偮偺忬懺偑偁傝丄幉嶕偺偁傞晹暘偺枌揹埵偑偁傞鑷抣傪挻偊傞偲Na+僠儍 儞僱儖偑奐偒丄 Na+偑 幉嶕撪偵棳擖偟傑偡丅偡傞偲枌揹埵偑偝傜偵忋徃偟丄暵偠偰偄偨椬愙偡傞Na+僠儍儞僱儖偑奐偒傑偡丅偙偺摦 嶌偑楢嵔偟丄妶摦揹埵偑幉嶕忋傪揱攄偟偰偄偒傑偡丅偙偺偲偒丄堦搙奐忬懺偵側偭偨Na+ 僠儍儞僱儖偼堦帪揑側晄妶壔忬懺偲側傞偨傔丄堦曽岦偵揱攄偡傞偙偲偑壜擻偲側傝傑偡丅
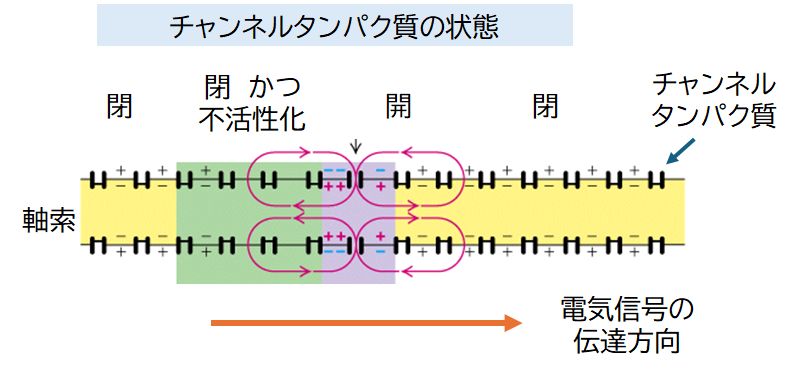
丂偙偺傛偆偵偟偰幉嶕忋傪揹婥揑側怣崋偑揱傢傞偺偱偡偑丄嬥懏偺拞傪揹婥偑岝懍偱棳傟傞偺偲偼堎側傝丄僞儞僷僋幙偺楢嵔斀墳偵傛偭偰婲偙傞尰徾偱偁傞偨傔丄偦偺 揱攄懍搙偼1/100昩丄1/1000昩偺儗儀儖偱偡丅傑偨丄怣崋丄偲偄偆偲懡偔偺忣曬傪娷傫偱偄傞傛偆側僀儊乕僕偱偡偑丄妶摦揹埵偑揱攄偟偨偐斲偐丄偡側傢 偪 ON/OFF偺俀抣偺怣崋偱偁傞偙偲偵傕拲堄偟偰偔偩偝偄丅
丂幉嶕偺枛抂偼丄忣曬傪揱払偡傞師偺僯儏乕儘儞丄偁傞偄偼嬝擏嵶朎側偳偵愙怗偟偰偄傑偡丅寢崌偼偣偢丄嫹偄娫寗傪傕偭偰愙怗偟偰偍傝丄偙偺晹埵傪僔僫僾僗偲傛傃傑 偡丅妶摦揹埵偺揱攄偑幉嶕偺廔枛乮僔僫僾僗慜晹乯偵払偡傞偲丄壗傜偐偺恄宱揱払暔幙偑偦偺娫寗偵曻弌偝傟傑偡丅堦曽丄庴偗庤懁偺嵶朎昞柺乮僔僫僾僗屻晹乯偵偼 偦 傟偵摿堎揑側恄宱揱払暔幙庴梕懱僞儞僷僋幙偑偁傝丄尞偲尞寠偺娭學偱恄宱揱払暔幙偑寢崌偡傞偙偲偱丄偦偺怣崋傪庴偗庢傞偙偲偵側傝傑偡乮恾10.1塃乯丅
丂曻弌偝傟偨恄宱揱払暔幙偼丄偦偺傑傑僔僫僾僗娫寗偵昚偭偰偄傞偲師偺妶摦揹埵偑摓払偟偨偙偲傪揱払偱偒傑偣傫丅偦偙偱丄僔僫僾僗傪儕僙僢僩偡傞偨傔丄恄宱 揱払暔幙偼偡偖偵夞廂偝傟傑偡丅夞廂傪峴偆偺偼僔僫僾僗慜晹偵偁傞僩儔儞僗億乕僞乕偲傛偽傟傞僞儞僷僋幙偱偡丅夞廂偝傟偨恄宱揱払暔幙偼嵞棙梡偝傟傑偡丅
丂偲偙傠偱丄偁傞恄宱嵶朎偐傜偁傞恄宱嵶朎傊偺忣曬揱払偼丄恄宱揱払暔幙偺曻弌偑偦偺傑傑庴偗庤懁偺恄宱嵶朎偺嫽暠傪堷偒婲偙偡偲偄偆傢偗偱偼偁傝傑偣傫丅侾 偮偺恄宱嵶朎偺庽忬撍婲偵偼暋悢偺恄宱嵶朎偑僔僫僾僗傪捠偟偰愙怗偟偰偄傑偡丅偦傟傜偺側偐偵偼丄嫽暠傪堷偒婲偙偡嫽暠惈僔僫僾僗傕偁傟偽丄嫽暠傪梷惂偡傞梷 惂惈僔僫僾僗傕偁傝傑偡丅傑偨丄恄宱嵶朎偺嫽暠偵婑梌偡傞掱搙傕僔僫僾僗偛偲偵堎側傝丄偦傟傜偑偡傋偰壛嶼偝傟偰丄嫽暠偡傞偐丄偟側偄偐偑寛傑傝傑偡丅
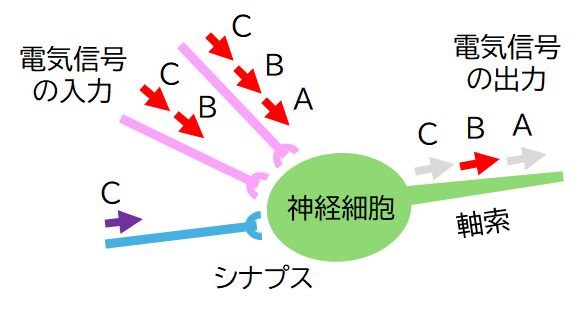
丂恾10.4偱偼丄偁傞恄宱嵶朎乮椢乯偵俀偮偺嫽暠惈僔僫僾僗乮僺儞僋乯偲侾偮偺梷惂惈僔僫僾僗乮惵乯偑愙怗偟偰偄傑偡丅恾偺A丄B丄C偼帪崗傪昞偟丄帪崗 A偱偼侾 偮偺嫽暠惈僔僫僾僗偐傜丄帪崗B偱偼俀偮偺嫽暠惈僔僫僾僗偐傜丄帪崗C偱偼俀偮偺嫽暠惈僔僫僾僗偵壛偊梷惂惈僔僫僾僗偐傜摨帪偵擖椡偑偁偭偨偙偲傪昞偟偰偄傑 偡丅偦偺寢壥丄帪崗A偱偼妶摦揹埵傪敪惗偡傞偵偼擖椡偑晄廫暘偱丄妶摦揹埵偼敪惗偟傑偣傫偑丄俀偮摨帪偵棃偨帪崗B偱偼妶摦揹埵傪敪惗偡傞偵廫暘側鑷抣偵払偟 偨偨傔妶摦揹埵偑敪惗丄帪崗C偱偼俀偮偺嫽暠惈僔僫僾僗偐傜摨帪偵擖椡偑偁偭偨傕偺偺丄梷惂惈偺僔僌僫儖偐傜傕摨帪偵擖椡偑偁偭偨偨傔丄妶摦揹埵傪敪惗偡傞偵 偼 帄傜側偐偭偨偙偲傪昞偟偰偄傑偡丅
丂擼偼恄宱嵶朎偺僱僢僩儚乕僋傪峔抸偟偰偄傑偡丅偨偲偊偽奜晹偐傜偺巋寖偱偁傞恄宱嵶朎偑嫽暠偡傞偲丄偙偆偟偨儊僇僯僘儉傪捠偟偰嫽暠偑峀偑傝丄僱僢僩儚乕僋忋偺恄宱嵶朎 偵嫽暠忬懺偵偁傞傕偺丄側偄傕偺偑惗傑傟丄壗傜偐偺僷僞乕儞偑惗傒弌偝傟傑偡丅傢傟傢傟偼偦偺嫽暠僷僞乕儞傛偭偰偳偺傛偆側奜晹巋寖偑棃偨偐傪姶抦偟偰偄傞偲 峫偊傜傟偰偄傑偡丅
丂峺慺偺榖埲崀丄僞儞僷僋幙偺婡擻傪慾奞偡傞偙偲偱帯椕揑岠壥傪惗偠傞栻偺榖戣傪偄偔偮偐庢傝忋偘傑偟偨丅偟偐偟丄栻偲偄偊偳傕丄杮棃偺僞儞僷僋幙偺婡擻傪 慾奞偡傞傢偗偱偡偐傜丄寬峃側恖偵偼撆偲側傝傑偡丅偙偙偱庢傝忋偘傞偺偼丄僞儞僷僋幙偺婡擻傪慾奞偡傞傑偝偵乽撆乿偺榖偱偡丅
丂恄宱宯偵嶌梡偡傞撆傪恄宱撆偲偄偄傑偡丅愛庢偟偨応崌丄偟傃傟傗嬝擏偺杻醿丄屇媧崲擄側偳偺徢忬偑尰傟傑偡丅崱夞搊応偟偨僞儞僷僋幙偵偼丄幉嶕忋偵偁偭偰揹 婥怣崋偺揱摫偵娭傢傞僀僆儞僠儍儞僱儖僞儞僷僋幙偲僔僫僾僗屻晹偵偁傞恄宱揱払暔幙庴梕懱僞儞僷僋幙偑偁傝傑偟偨丅偨偲偊偽僼僌撆偺惉暘僥僩儘僪僩僉僔儞傗僒 僜儕撆惉暘偺僥傿僥傿僂僗僩僉僔儞偼Na+僠儍儞僱儖偵寢崌偟丄幉嶕忋偺妶惈揹埵偺揱攄傪慾奞偟傑偡丅傾儅僈僒僿價偺撆兛-僽儞僈儘僩僉僔儞傗僂儈僿 價偺撆僄儔僽僩僉僔儞側偳偼僔僫僾僗屻晹偵偁傞傾僙僠儖僐儕儞庴梕懱傪慾奞偟丄恄宱揱払暔幙傾僙僠儖僐儕儞偺寢崌傪慾奞偡傞偨傔丄僔僫僾僗偵偍偗傞忣曬揱払偑幷抐偝傟偰偟 傑偄傑 偡丅
丂偙偺懠偵傕丄僔僫僾僗偵懚嵼偡傞峺慺傾僙僠儖僐儕儞僄僗僥儔乕僛傪慾奞偡傞恄宱撆傕偁傝傑偡丅偙傟偵偮偄偰偼嫽枴偁傞榖戣偑偁傝傑偡偺偱丄彮偟徻嵶偵弎傋偨 偄偲巚偄傑偡丅
丂傾僙僠儖僐儕儞偼庡偵塣摦恄宱偲嬝擏偺愙崌晹偺僔僫僾僗偱梡偄傜傟傞恄宱揱払暔幙偱偡丅擼偐傜塣摦恄宱傪捠偟偰壓偝傟偨巜椷忣曬偑嬝嵶朎傑偱摓払偡傞偲丄傾 僙僠儖僐儕儞偑曻弌偝傟丄偦偺庴梕懱傪傕偮崪奿嬝偑廂弅偟傑偡丅偦偟偰丄嵶朎奜偵曻弌偝傟偨傾僙僠儖僐儕儞偼嬌傔偰抁帪娫偱丄峺慺傾僙僠儖僐儕儞僄僗僥儔乕僛 偵 傛偭偰暘夝偝傟丄僐儕儞偲恷巁偵側傝丄僐儕儞偼嵞傃僔僫僾僗慜晹偵媧廂偝傟丄嵞棙梡偝傟傑偡乮恾10.5乯丅
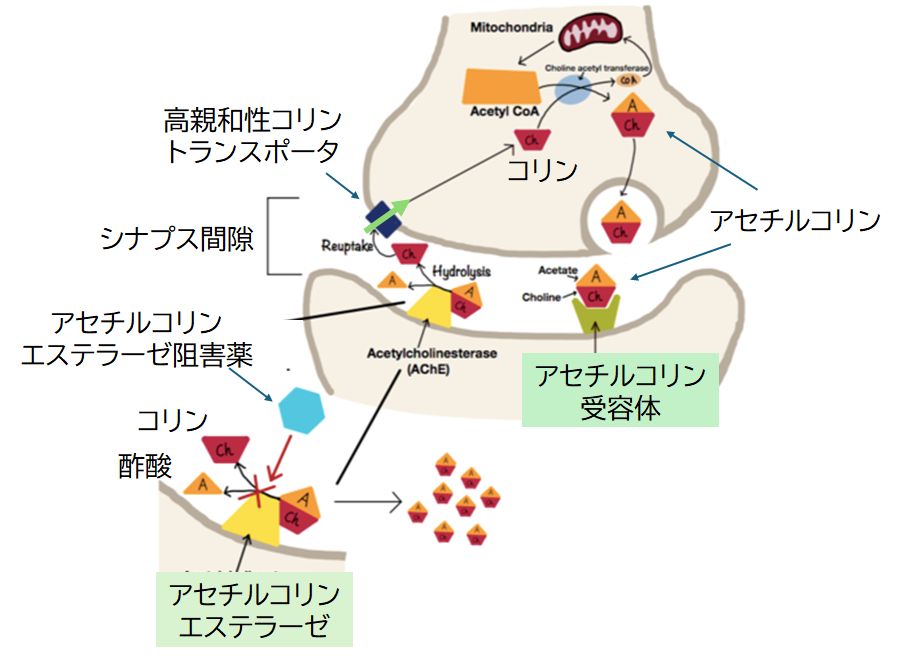
丂傕偟丄偙偺傾僙僠儖僐儕儞僄僗僥儔乕僛偺摥偒偑壗傜偐偺棟桼偱慾奞偝傟傞偲丄僔僫僾僗偵偼傾僙僠儖僐儕儞偑挿帪娫懾嵼偡傞偙偲偲側傝丄怴偨側怣崋偑擼偐傜敪 偣傜傟偰傕姶抦偡傞偙偲偑偱偒側偔側傝傑偡丅1994擭偵婲偒偨徏杮僒儕儞帠審丄1995擭偵婲偒偨抧壓揝僒儕儞帠審偺僒儕儞偼丄傑偝偵偙偺傾僙僠儖僐儕儞僄 僗 僥儔乕僛偺慾奞嵻偱偟偨丅傑偨丄2008擭丄椻搥長巕偵娷傑傟偨擾栻惉暘儊僞儈僪儂僗偑榖戣偵側傝傑偟偨偑丄偙傟傕丄僒儕儞傛傝偼撆惈偑庛偄傕偺偺丄傾僙僠儖 僐儕儞僄僗僥儔乕僛偺慾奞嶌梡偑偁傞偙偲偑抦傜傟偰偄傑偡丅
丂偟偐偟丄戞俈夞偺憂栻偺島媊偱偼丄峺慺慾奞嵻偑栻偲偟偰嶌梡偡傞榖傪偟傑偟偨丅幚偼丄傾僙僠儖僐儕儞僄儔僗僞乕僛傪慾奞偡傞偙偲偱帯椕岠壥傪傕偮栻傕偁傞 偺偱偡丅 擼偺怺晹偺儅僀僱儖僩妀傗拞妘偲偄偆晹暘偵偼僐儕儞嶌摦惈偺僯儏乕儘儞乮傾僙僠儖僐儕儞傪恄宱揱払暔幙偲偡傞恄宱嵶朎乯偑懚嵼偟傑偡丅儅僀僱儖僩妀偼慜摢梩(堄 巙丄巚峫丄憂憿側偳偺惛恄婡擻偲娭楢偡傞晹埵) 傗摢捀梩 (夛榖丄峴摦丄寁嶼丄埵抲偺擣幆側偳偵娭楢偡傞晹埵) 傊丄拞妘偼奀攏乮婰壇傗嬻娫妛廗擻椡偵娭傢傞晹 埵乯傊偲幉嶕傪怢偽偟偰偄傑偡丅傾儖僣僴僀儅乕偵偐偐傞偲丄偙偺僐儕儞嶌摦惈僯儏乕儘儞偵婡擻掅壓偑婲偙傝丄偡側傢偪丄曻弌偝傟偨傾僙僠儖僐儕儞偑廫暘偵庴梕懱 偵寢崌偡傞慜偵暘夝偝傟偰偟傑偄丄忣曬揱払偑偆傑偔偄偐側偔側偭偰丄婰壇忈奞側偳偺徢忬偑尰傟傞偲峫偊傜傟偰偄傑偡丅偙傟傪傾僙僠儖僐儕儞壖愢偲偄偄傑偡丅
丂偦偙偱丄僔僫僾僗偵偍偗傞傾僙僠儖僐儕儞偺懾嵼帪娫傪挿偔偡傟偽傾儖僣僴僀儅乕昦偺徢忬偑夵慞偝傟傞偺偱偼側偄偐偲偄偆峫偊偐傜奐敪偝傟偨偺偑丄僄乕僓僀 偺 傾儕僙 僾僩偲偄偆栻偱偡丅傾僙僠儖僐儕儞僄僗僥儔乕僛傪壜媡揑偵慾奞偡傞偙偲偵傛傝丄傾僙僠儖僐儕儞偺暘夝傪梷惂偟偰丄僔僫僾僗偵偍偗傞傾僙僠儖僐儕儞検傪憹壛偝偣丄傾 僙僠儖僐儕儞偑恄宱揱払暔幙偲偟偰嶌摦偡傞恄宱宯傪晩妶偡傞偲偄偆傕偺偱偟偨丅僼傽僀僓乕偲偺採実偵傛傝崙奜偱傕俉妱偺巗応愯桳棪傪屩傞傾儖僣僴僀儅乕宆擣抦 徢恑峴梷惂嵻偱偟偨乮偨偩偟丄2013擭摿嫋偑愗傟傑偟偨乯丅
丂恾10.7偼丄傾僙僠儖僐儕儞僄僗僥儔乕僛偵偙傟傑偱弎傋偨偝傑偞傑側婎幙偑寢崌偟偰偄傞條巕傪幚尡僨乕僞傪傕偲偵CG偱昤偄偨傕偺偱偡丅偙傟傑偱壗搙傕榖偟偰偒 偨丄僞儞僷僋幙偲尞偲尞寠偺娭學偑惉傝棫偮壔妛暔幙偼寛偟偰侾捠傝偱偼側偔丄傑偨丄偦偺寢崌偺嫮偝傗壜媡揑側寢崌偐晄壜媡揑側寢崌偐側偳偺堘偄偵傛偭偰丄偦傟 偑 堷偒婲偙偡惗棟尰徾傕傑偨侾捠傝偱側偄偙偲偑傢偐偭偰偄偨偩偗偨偱偟傚偆偐丅
丂偙偙偐傜偼姶妎恄宱偵娭傢傞榖戣傪偄偔偮偐庢傝忋偘偨偄偲巚偄傑偡丅奜晹偐傜偺忣曬傪丄傢傟傢傟偼丄僞儞僷僋幙傪捠偟偰偄偐偵庴梕偟偰偄傞偺偐偲偄偭偨榖 戣偱偡丅傑偢偼枴妎偱偡丅
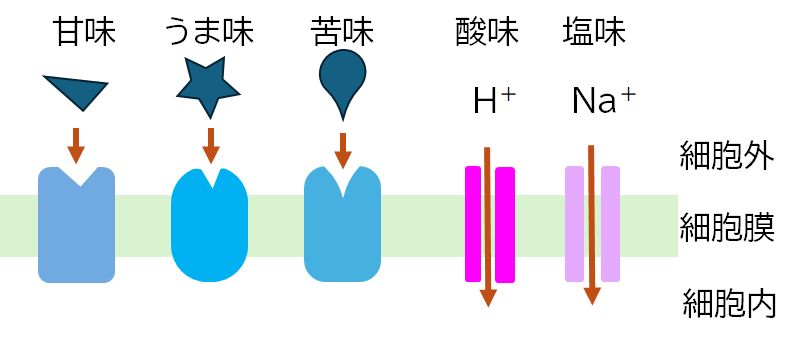
丂枴妎偵偼丄娒枴丄偆傑枴丄嬯枴丄巁枴丄墫枴偺俆偮偺婎杮枴偑偁傝傑偡丅偙傟傜偼怘傋暔偵娷傑傟傞壔妛暔幙偲枴嵶朎偵敪尰偡傞枴妎庴梕懱偲傛偽傟傞僞儞僷僋 幙偲偺憡屳嶌梡偵傛偭偰堷偒婲偙偝傟傞傕偺偱偡丅枴妎庴梕懱偵偼俀偮偺僞僀僾偑偁傝傑偡丅堦偮偼俧僞儞僷僋幙嫟栶宆庴梕懱偲傛偽傟傞傕偺偱丄娒枴丄偆傑枴丄嬯 枴偺庴梕懱偑偙傟偵懏偟傑偡丅偙傟偼丄怘暔側偳偵娷傑傟傞暔幙偑尞偲尞寠偺娭學偱偙傟傜庴梕懱偵寢崌偡傞偲丄娒枴丄偆傑枴丄嬯枴傪姶偠傑偡丅偨偲偊偽丄娒枴庴 梕懱偺婎幙偼丄僌儖僐乕僗乮僽僪僂摐乯傗僗僋儘乕僗乮嵒摐乯偱偡偑丄恖岺娒枴椏傕偙偺庴梕懱偵寢崌偡傞偨傔丄傢傟傢傟偵偲偭偰娒偄偲姶偠傞傢偗偱偡丅傕偆堦偮 偺枴妎庴梕懱偺僞僀僾偼僀僆儞僠儍儞僱儖宆庴梕懱偱偡丅巁枴偲墫枴偺庴梕懱偑偙傟偵懏偟傑偡丅H+乮悈慺僀僆儞乯丄Na+乮僫 僩儕僂儉僀僆儞乯傪姶抦偡傞偙偲偱丄巁枴丄墫枴傪姶偠偰偄傑偡丅
丂枴嵶朎偵敪尰偡傞枴妎庴梕懱傊偺寢崌偁傞偄偼僀僆儞偺摟夁偱庴偗庢傜傟偨枴暔幙偺忣曬偼丄枴嵶朎撪偺僔僌僫儖揱払宯傪宱偰恄宱揱払暔幙偺曻弌傪懀偟丄偙傟 偵 傛傝枴妎恄宱偺嫽暠傪堷偒婲偙偟傑偡丅偙偺嫽暠偼擼偵揱払偝傟丄枴偲偟偰擣幆偝傟傑偡丅侾杮偺枴妎恄宱偼10屄掱搙偺枴嵶朎偲僔僫僾僗傪宍惉偟偰偄傑偡丅娒枴 傗嬯枴側偳偺扨堦偺僇僥僑儕乕偺枴偵懳偟偰墳摎偡傞恄宱偑偁傞堦曽偱丄僇僥僑儕乕偺堎側傞偝傑偞傑側枴偵懳墳偡傞恄宱傕偁傝丄偦傟偧傟偺枴墳摎惈偼暋嶨偱偡丅
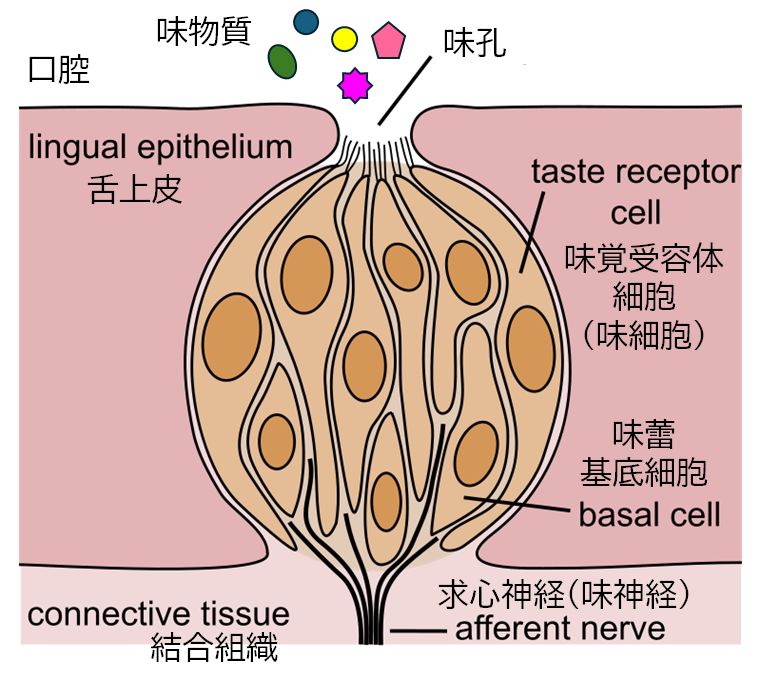
丂側偍丄恏枴丄椓枴偼丄恄宱廔枛偑捈愙僙儞僒乕偲側偭偰巋寖傪姶抦偡傞懱惈姶妎宯偵懏偟丄枴妎偲偼嬫暿偝傟偰偄傑偡丅傑偨丄僇儖僔僂儉枴丄帀朾枴丅扽悈壔暔枴 側偳偵墳摎偡傞枴嵶朎偺懚嵼傕帵嵈偝傟偰偄傑偡偑丄傑偩偦偺儊僇僯僘儉偼尋媶偑巒傑偭偨偽偐傝偺傛偆偱偡丅
丂擋偄偼丄嬻婥拞傪昚偆擋偄暘巕偑丄旲峯撪偺忋旂偵偁傞歬嵶朎偺庴梕懱僞儞僷僋幙偵尞偲尞寠偺娭學偱寢崌偟丄偦偺忣曬偑歬恄宱傪揱傢偭偰擼偵揱偊傜傟偨傕偺 偱偡丅擋偄暘巕偵懳偡傞庴梕懱僞儞僷僋幙偼丄僎僲儉偺夝撉偐傜丄儅僂僗偱1,000庬椶丄僸僩偱350庬椶偔傜偄懚嵼偟偰偄傞乮偡側傢偪尞寠偺宍偑偦傟偩偗偺 庬 椶偁傞乯偲悇掕偝傟丄屄乆偺歬嵶朎偼偄偢傟偐堦偮偺庴梕懱偩偗傪敪尰偟偰偄傑偡丅堦曽丄侾偮偺擋偄暘巕偼暋悢偺庴梕懱偲堎側偭偨尞偲尞寠偺娭學乮偡側傢偪丄擋 偄暘巕偺庴梕懱傊偺寢崌晹埵偑堎側傞乯偱寢崌偡傞偙偲偑偱偒丄偦傟傜偺慻傒崌傢偣偱擋偄傪姶抦偟偰偄傑偡丅偟偨偑偭偰丄枴妎偺傛偆偵丄娒枴庴梕懱偵寢崌偡傞傕 偺偼 偡傋偰娒偄偲偄偆扨弮側傕偺偱偼側偔丄暘巕偲偟偰帡偰偄偰傕丄寢崌偡傞庴梕懱偺慻傒崌傢偣偑堎側傟偽丄偦傟傜傪嬫暿偡傞偙偲偑偱偒傞傢偗偱偡丅偝傜偵丄懡悢偺擋偄暘 巕傪娷傓怘傋暔傗懠偺屄懱偺暘斿塼側偳偺懳徾偼丄朿戝側慻傒崌傢偣偺歬嵶朎偐傜偺忣曬傪擼偑張棟偟偰姶抦偡傞偙偲偵側傝傑偡丅偟偨偑偭偰丄擋偄偼丄杮棃朿戝側 忣曬 検傪傕偭偨姶妎偲偄偊傑偡丅偦傟偼丄僀僰傗僱僘儈偺峴摦傪尒傟偽擺摼偑偄偔偐偲巚偄傑偡偑丄堦曽丄帇妎偐傜偺忣曬偑埑搢揑偵桪埵偲側偭偨僸僩偱偼懡偔偺堚揱巕 偑婾堚揱巕壔偟丄悐戅偟偰偄傑偡乮戞05夞島媊帒椏 5.5 婾堚揱巕壔 嶲徠乯丅
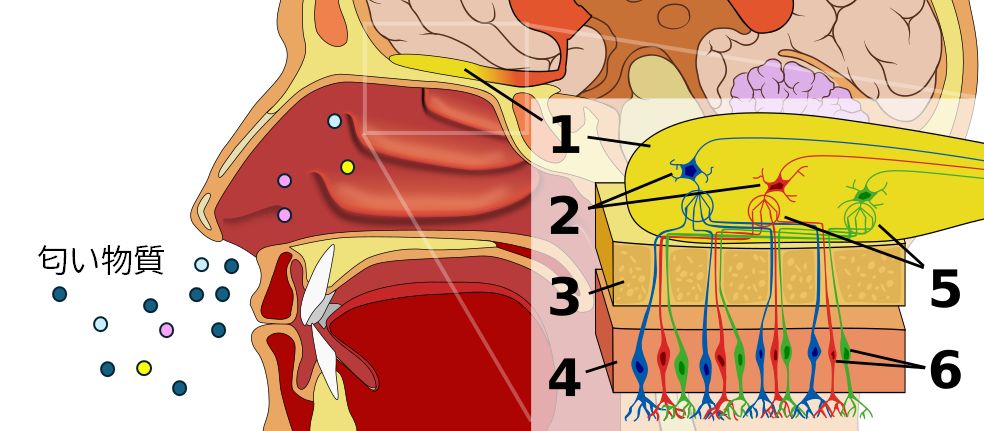 丂丂
丂丂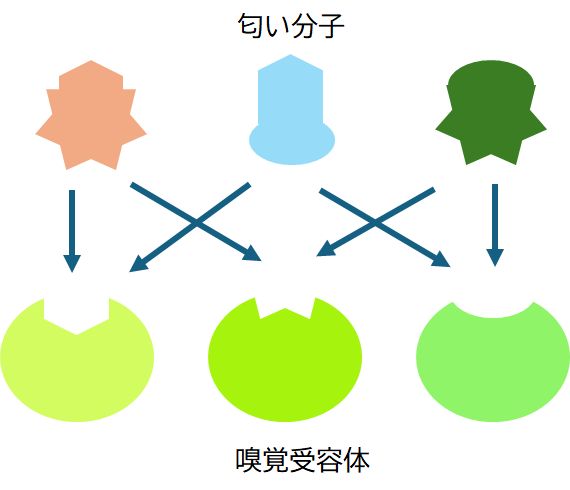
丂娐嫬壏搙偺姶抦偼廳梫側婡擻偺堦偮偱偡丅幚偼丄旂晢昞柺傗懱撪偺壏搙傪儌僯僞乕偟偰偄傞偺傕僞儞僷僋幙偱偡丅偟偐偟丄偙傟傑偱偺庴梕懱僞儞僷僋幙偲偼堎側傝丄壏搙偼暔幙 偱 偼側偄偨傔丄尞偲尞寠儌僨儖偱偼偦偺姶抦儊僇僯僘儉傪愢柧偱偒傑偣 傫丅壏搙傪姶抦偡傞僞儞僷僋幙偼壏搙姶庴惈僞儞僷僋幙偲傛偽傟丄歁擕椶偱偼11庬椶偑曬崘偝傟偰偍傝丄偦傟偧傟姶抦偡傞壏搙椞堟偑堎側偭偰偄傑偡丅壏搙姶庴惈僞 儞僷僋幙偼僀僆儞僠儍儞僱儖僞儞僷僋幙偱丄偦傟偑摿掕偺壏搙椞堟偱奐岥偟丄僀僆儞傪捠偡偙偲偱妶摦揹埵傪敪惗偟丄姶妎恄宱傪捠偟偰擼偵揱偊傜傟丄壏搙傪抦妎偟 偰偄傞偲峫偊傜傟偰偄傑偡丅
丂僀僆儞僠儍儞僱儖偺奐岥偵偼丄壏搙姶庴惈僞儞僷僋幙偺梙傜偓偺戝偒偝偑娭梌偟偰偄傞偲峫偊傜傟傑偡丅偦傕偦傕丄僞儞僷僋幙暘巕偺梙傜偓偺戝偒偝偼壏搙偑崅 偔 側傞偲戝偒偔側傝傑偡偑丄偦偺壏搙埶懚惈偼丄峔惉偡傞傾儈僲巁娫偺憡屳嶌梡偺戝偒偝偵埶懚偟傑偡丅偡側傢偪丄偦偺傾儈僲巁攝楍偵埶懚偟傑偡丅偟偨偑偭偰丄庬椶偺 堎側傞壏搙姶庴惈僞儞僷僋幙偼丄偦傟偧傟屌桳偺壏搙椞堟偱奐岥偟丄偦偺偙偲傪捠偟偰丄傢傟傢傟偼壏搙傪抦妎偟偰偄傞偲峫偊傜傟傑偡丅偨偩偟丄偁傞摿掕偺壏搙 偱丄傑傞偱僗僀僢僠偑 on/off偡傞傛偆偵僠儍儞僱儖偑奐岥/暵岥偡傞儊僇僯僘儉偼偄傑偩柧傜偐偵偝傟偰偄傑偣傫丅
丂偮偄偱側偑傜丄偙偺壏搙姶庴惈僞儞僷僋幙偵偼壔妛暔幙巋寖傗暔棟巋寖偵傕墳摎偡傞傕偺偑偁傝傑偡丅43亷埲忋偱妶惈壔偝傟傞壏搙姶庴惈僞儞僷僋幙偺堦偮丄 俿俼俹倁侾 偼丄偦偺壏搙椞堟偑傢傟傢傟偵偲偭偰婋尟側壏搙偱偁傞偨傔乭捝傒乭傪敽偆姶妎傪傕偭偰偦偺婋尟惈傪抦傜偣偰偔傟傑偡偑丄搨恏巕偺庡惉暘僇僾僒僀僔儞偲尞偲尞寠 偺娭學偑惉傝棫偭偰偄傞晹埵偑偁傝丄 寢崌偡傞偲丄擼偵偼捝傒偵帡偨姶妎偱偁傞乽恏枴乿偲偟偰擣幆偝傟傞偙偲偑傢偐偭偰偄傑偡丅恏偄暔傪怘傋傞偲娋偑弌傞偺傕丄擼偑俿俼俹倁侾偑妶惈壔偝傟偰丄擬偄偲岆擣偟偰偄 傞偐 傜偲峫偊 傜傟傑偡丅堦曽丄23乣26亷埲壓偱妶惈壔偡傞俿俼俹俵俉偲傛偽傟傞壏搙姶庴惈僞儞僷僋幙偼丄儊儞僩乕儖偲尞偲尞寠偺娭學偑惉棫偟偰偄傞晹埵偑偁傝丄偙偪傜偼寢崌偡傞偲椻 姶傪姶偠傞偙偲偵側傝傑偡丅
乮嶲峫乯晉塱恀嬚亀壏搙姶庴惈TRP僠儍儞僱儖亁惗壔妛丄94 (2)丄236-257 (2022)
丂僸僩偵偼愒怓丄椢怓丄偦偟偰惵怓偺岝偵姶庴惈傪傕偮俁庬椶偺僆僾僔儞偲傛偽傟傞僞儞僷僋幙偑偁傝傑偡丅偙傟傜偼岝庴梕懱僞儞僷僋幙偲傕傛偽傟傑偡偑丄岝傕壏搙摨 條丄暔幙偱偼偁傝傑偣傫偐傜丄偦偺庴梕儊僇僯僘儉傪尞偲尞寠偺娭學偱愢柧偡傞偺偼柍棟偑偁傝傑偡丅幚偼丄僆僾僔儞偺側偐偵偼丄岝偵斀墳偡傞儗僠僫乕儖偲偄偆壔 妛 暔幙偑杽傔崬傑傟偰偄傑偡丅愒丄椢丄惵偺俁庬椶偺岝姶庴惈僆僾僔儞偼屳偄偵偦偺傾儈僲巁攝楍偑堎側傞偙偲偵傛傝丄儗僠僫乕儖偑斀墳偡傞岝偺攇挿偑堎側偭偰偄傞偺偱偡 乮恾10.10乯丅 俁尨怓偱怓傪姶偠傞巇慻傒傪棟夝偟偰偄偨偩偔偨傔偵丄恾10.11偵丄扨怓岝偺墿怓偺岝偱傕丄愒怓岝偲椢怓岝偺崿崌偱傕墿怓偵尒偊傞棟桼傪丄俁庬椶偺僆僾僔儞偺斀墳偺 巇曽偱愢柧偟偰偄傑偡丅
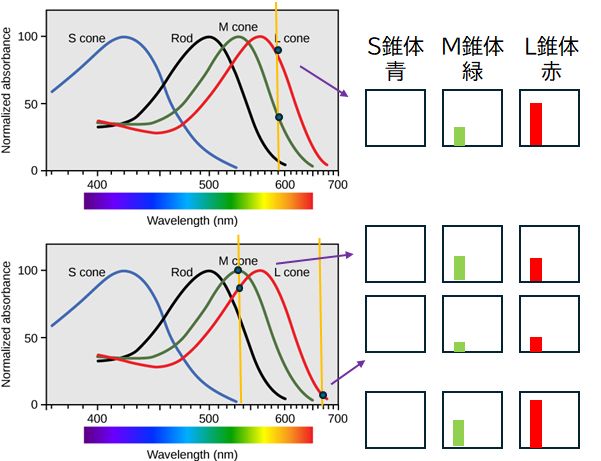
丂傢傟傢傟偼丄俁尨怓偺慻傒崌傢偣偱怓傪敾抐偟偰偄傑偡丅僥儗價傕僷僜僐儞偺儌僯僞乕傕俁尨怓偱怓傪昞尰偟偰偄傑偡丅偦偺偨傔丄俁尨怓偱怓傪昞偡偙偲偵暔棟妛揑 昁慠惈偑偁傞傛偆偵巚偄偑偪偱偡偑丄偙傟偼扨偵恑壔偺寢壥丄傢傟傢傟傪娷傓楈挿椶偑俁庬椶偺僆僾僔儞傪傕偭偰偄傞偐傜偲偄偆惗暔妛揑棟桼偵偡偓傑偣傫丅幚 嵺丄歁擕椶偺懡偔偼俀庬椶偟偐傕偪傑偣傫偟丄捁椶側偳偼係庬椶傕偭偰偍傝丄偦傟傜僆僾僔儞偺岝偵懳偡傞斀墳偺慻傒崌傢偣偱怓傪姶抦偟偰偄傑偡丅壗庬椶傕偮偐偼 偁偔傑偱傕恑壔偲偄偆楌巎偺嬼慠偵夁偓傑偣傫偑丄俁尨怓偲偄偆偺偑丄擼偑張棟偡傞忋偱嵟揔壔偝傟偨寢壥偱偁傞偲偄偆懁柺偑偁傞偐傕偟傟傑偣傫丅
丂偪側傒偵丄僸僩偱偼丄愒怓姶庴惈僆僾僔儞偵懡宆乮俽俶俹乯偑偁傞偙偲偑抦傜傟偰偄傑偡丅偙傟傪愒侾丄愒俀偲偱傕傛傇偲丄偙傟傜偼傢偢偐偱偡偑斀墳偡傞岝偺攇 挿偑堘偄傑偡丅偙偺僆僾僔儞偺堚揱巕偼惈愼怓懱偱偁傞倃愼怓懱偵偁傞偨傔丄彈惈偼俀偮傕偪傑偡偑丄抝惈偼侾偮偟偐傕偪傑偣傫乮抝惈偺応崌丄傕偆侾杮偼倄愼怓懱 偱丄偦偙偵偼僆僾僔儞堚揱巕偼偁傝傑偣傫乯丅偲側傞偲丄彈惈偱偼丄愒侾傪俀偮傕偮恖丄愒俀傪俀偮傕偮恖丄愒侾偲愒俀傪侾偮偢偮傕偮恖偑偄偰丄嵟屻偺恖偼愒侾丄 愒俀丄椢丄惵偺係尨怓偱怓傪姶抦偟偰偄傞偙偲偵側傝傑偡丅堦曽丄抝惈偼丄愒侾偐愒俀偐丄偳偪傜偐堦曽偩偗傪傕偪丄偟偨偑偭偰丄偳偪傜偱偁偭偰傕俁尨怓偱尒偰偄 傞 偙偲偵側傞偺偱偡偑丄愒傊偺斀墳偑旝柇偵堎側傞偙偲偵側傝傑偡丅偦傟偧傟偺僆僾僔儞偑偳偺攇挿偵斀墳偡傞偐偼幚尡偱應掕偱偒傑偡偑丄偙偆偟偨堘偄偑怓偺尒偊曽 偵偳偺傛偆偵斀塮偟偰偄傞偐偼丄幚偼撲側偺偱偡丅偍屳偄偵偁傞怓傪尒偰乽愒偩乿偲尵偭偰傕丄偳偺傛偆側怓偁偄偲偟偰憡庤偵偼尒偊偰偄傞偐傪偍屳偄偵抦傞偙偲偑 偱 偒側偄偐傜偱偡丅
乮拲乯擔杮恖彈惈偺乮愒侾丄愒侾乯丄(愒侾丄愒俀)丄(愒俀丄愒俀) 偺妱崌偼偦傟偧傟 61亾丄34亾丄5亾丄抝惈偺愒侾丄愒俀偺妱崌偼偦傟偧傟 78亾丄22亾偲偄偆僨乕僞偑偁傝傑偡丅乮愒侾丄愒侾乯丄(愒侾丄愒俀)丄(愒俀丄愒俀) 偺俁幰偺娫偱丄岥峠偺旝柇側怓崌偄偺堘偄偵懳偡傞擣幆擻椡偑旝柇偵堎側偭偰偄傞偺偐傕偟傟傑偣傫丅
丂怓妎丄歬妎丄枴妎偵娭傢傞堚揱巕丄偦偟偰偦偙偐傜嶌傜傟傞僞儞僷僋幙偵偮偄偰傒偰偒傑偟偨偑丄偄偢傟偵傕傑偩娤應偝傟偰偄側偄懡宆偑偁傞壜擻惈偑偁傝傑 偡丅傢傟傢傟偼丄摨偠傕偺傪尒傟偽丄摨偠擋偄傪歬偘偽丄摨偠傕偺傪怘傋傟偽丄摨偠傛偆偵尒偊丄摨偠傛偆偵擋偄傪姶偠丄摨偠傛偆偵枴傪姶偠偰偄傞偲巚偭偰偄傑偡 偑丄幚偼丄偦偺尒偊曽丄擋偄傗枴偺姶偠曽偑堎側偭偰偄傞偺偐傕偟傟傑偣傫丅偟偐偟丄偦偺堘偄傪抦傞弍傪崱偺偲偙傠傢傟傢傟偼傕偭偰偄傑偣傫丅偱傕丄抦幆偲偟 偰丄偦偺偙偲傪抦偭偰偍偔偙偲偼堄枴偁傞偙偲偐傕偟傟傑偣傫丅
![]()