DNAとタンパク質を通して生命現象を見るというアプローチが確立してくるにつれ、大きく変化した分野に、創薬 Drug design があります。医学、薬学、生理学、生命科学がこれに関与するのはわかると思いますが、これらの分野に、物理学、化学、情報科学(とくにコンピュータ)といった異分野の研究 者 を巻き込み、新たに誕生したバイオインフォマティクス (生物情報学) という学問分野の主要課題の一つともなり、創薬は学際的科学となって発展しています。今回は、前回の酵素の応用編として、そんな創薬の世界を覗いてみましょう。
薬は、一昔前までは、もっぱら経験による生薬(薬効をもつ天然産物)の発見に頼っていました。その有効性や毒性が長い年月の中でチェックされ、有効成分の 抽出、さらにはその類似化合物の合成による大量生産が可能となると、薬として市場に出回りました。 たとえば、医学の父とよばれるヒポクラテス(460〜377B.C.)の時代にはすでに、柳に解熱鎮痛作用があることが知られていました。中国の古典にも、柳の枝を使った 楊 枝は、歯痛のとき噛めば痛みが止まる、との記載が見られます。1820年代になると、柳(属名Salix) の解熱鎮痛作用をもつ有効成分(サリシンと命名)が解明されるのですが、あまりに苦く、薬としては使われませんでした。しかし1897年、サリシンの類似化合物アセチルサ リチ ル酸が発見され、同様の効果をもつことが分かると、1899年、バイエル社からアスピリンの商品名で発売されます。しかし、なぜ鎮痛解熱効果があるかはわかっ ていませんでした。アスピリンの作用メカニズム(医学、薬学では"機序"といいます)が解明されたのは1971年のことでした(1982年、解明した3人の研 究者がノーベル医学生理学賞を受賞しています)。 その後、DNAとタンパク質の知識が増えるつれ、さまざまな薬の作用メカニズムが明らかになり、現在では、経験的に、発見的に見つけ出すだけでなく、薬を設計する時代へ と移ってきています。
多くの薬はタンパク質に作用することが分かっています。そして多くの場合、特定のタンパク質の機能を阻害することで治療的効果をもつことが分かってきました。しかし、タ ンパク質の機能は生命活動に必要な機能のはずです。なぜそれを阻害することが治療につながるのでしょうか。そこで、前回お話した酵素を例に薬の作用メカニズム について見ていきます。
具体的な例でお話しする方がわかりやすいと思います。
高脂血症の治療薬について見ていきましょう。コレステロール値が異常に高い値を示すようになると、脂質異常症(高脂血症)と診断され、治療が必要となります。動脈の壁に コレステロー ルなどの脂質が沈着すると、次第に動脈の弾力性が失われ(動脈硬化)、脳卒中や心筋梗塞などの血管障害が起こるからです。このとき処方されるのが高脂血症薬で す。 そもそもコレステロールや中性脂肪を合わせて脂質と呼びますが、その中でも、コレステロールは、私たちの体にとって必要な細胞の構成成分であり、重要な栄養素です。そのた め、コレステロールの大部分(およそ80%)は、実は体内で合成されています。しかし、高脂血症となった場合には、食事で摂取する量を制限するのはもちろんで すが、 体内でのコレステロール合成過程も抑制し、コレステロール値を是正することが必要となります。
コレステロールは肝臓でいくつかの化学反応過程を経て合成されます。その中でも合成速度を決定する過程(律速過程)が HMG-CoAという化学物質からメバロン酸を合 成する過程で、HMG-CoA還元酵素がその化学反応を触媒しています(すなわち、HMG-CoA還元酵素の基質がHMG-CoAで、生成物がメバロン酸とな ります)。メバロン酸は、さらにいくつかの過程を経て、最終的にコレステロールとなります。したがって、このHMG-CoA還元酵素の働きを阻害すれば、コレ ス テロールの合成を抑制できることになります。
こうした考えのもとに作られたのが、ファイザー社のアトルバスタチン、メルク社のシンバスタチン、三共製薬のプラバスタチンなどのスタチン系の高脂血症薬です。いずれも HMG-CoA還元酵素を標的タンパク質とし、その働きを阻害するように作られたものです。

他の例としては、食事により摂取された炭水化物(デンプン)は、小腸において酵素αアミラーゼにより二糖類に分解され、さらに小腸粘膜に存在する酵素αグ ルコシダー ゼによって単糖類(ブドウ糖など)にまで分解されてから小腸から吸収されますが、これら酵素に結合して、本来の基質の結合を阻害するαアミラーゼ阻害薬および αグルコシダーゼ阻害薬が糖の吸収を抑えることができ、糖尿病や肥満の治療薬として使われています。また、摂取した脂肪を消化管内で分解する酵素リパーゼの作 用を阻害する内臓脂肪減少薬がありますが、市販薬として売り出されることになると最近話題になりました。
このように、ある病状を呈する場合、ある特定のタンパク質の機能を抑制することで治療的効果がある場合には、そのタンパク質の機能を抑制する阻害剤が薬として利用できる わけです。
タンパク質の機能を阻害するためには、タンパク質と基質の相互作用を阻害すればいいわけですから、タンパク質の活性部位(鍵穴)に入り込んで、基質の結合 を阻止することが基本となります。また、薬が副作用をもたないようにするためには、その標的タンパク質とのみ相互作用することが望ましく、標的タンパク質と特 異的に相互作用する必要があります。すなわち薬剤分子も、酵素と鍵と鍵穴の関係をもって結合する必要があります。
薬は、本来の基質と活性部位への結合をめぐって競合することになります。この争いに勝つためには、薬は本来の基質より強く、あるいはより長く結合するこ と、また酵素によって触媒され、化学変化を起こして放出されないことなどが必要です。本来の基質は酵素に触媒され何らかの生成物となり、酵素から離れていきま す。しかし、薬は結合した後変化せず、しばらく結合していることができれば、本来の基質が酵素に結合する機会を奪うことができます。結果として、基質の化学反 応を触媒す るという酵素の機能を阻害することになるわけです。
薬の作用メカニズム(作用機序)を調べると、われわれ素人には聞きなれないカタカナの用語が頻出し、何を言っているのかよくわかりません。しかし、酵素、 基 質、生成物がそれぞれどれか、そして生成物が果たす生理学的役割、すなわち阻害される生理的機能が何かを意識して読めば、幾分理解しやすくなると思います。
たとえばWikipediaではペニシリンについて次のように書かれています。 「ペニシリンはβ-ラクタム系抗生物質であり、真正細菌の細胞壁の主要成分であるペプチドグリカンを合成する酵素(ペプチドグリカン合成酵素)と結合し、その活性を阻害す る。この結果ペニシリンが作用した細菌はペプチドグリカンが作れなくなり、その分裂に伴って細胞壁は薄くなり、増殖が抑制される(静菌作用)。また細菌は細胞 質の浸透圧が動物の体液よりも一般に高いため、ペニシリンの作用によって細胞壁が薄くなり損なわれた細菌細胞では外液との浸透圧の差から細胞内に外液が流入 し、最終的には溶菌を起こして死滅する(殺菌作用)」
これを読み解くには、まず抗生物質ペニシリンが阻害する酵素は細菌がもつタンパク質、ペプチドグリカン合成酵素であることをまず確認します。この酵素の本 来の基質については書かれていませんが、生成物はペプチドグリカンです。生成物は細菌の細胞壁の主要成分ということから、この酵素の阻害によって、細胞壁が作 られなくなり、結果的に細胞は死ぬ、という大まかな話の筋道は読み取れるかと思います。
ちなみにペニシリンは、細菌だけが持つ細胞壁の合成を行う酵素を標的としてこれを特異的に阻害する薬剤です。細胞壁は細菌の生存に必須な構造ですが、ヒトを含めた真核生 物には存在しないため、ペニシリンは細菌に対する選択毒性が高く、ヒトに対する毒性は低いことになります(ただし、腸内細菌も殺すことがあり、そのため腸内細 菌叢のバランスが崩れ、下痢などの副作用が起こることがあります)。また、ウイルスにも細胞壁はありませんので、抗生物 質はウイルスには効かないということでもあります。ただし、抗生物質の最大の問題点の一つは、細菌側でその酵素に変異が起き、本来の基質との鍵と鍵穴の関係を 保ちながら、すなわちその機能を維持しながら薬剤との鍵と鍵穴の関係性が崩れてしまう、いわゆる耐性菌の出現でしょう。
薬の標的が酵素であり、基質と同様に活性部位に「鍵と鍵穴の関係」で結合するとなると、鍵穴の形がわかれば、薬を設計できることになります。実際、多くの 酵素の立体構造(形)が明らかになっており、鍵穴の形がわかっている酵素の例は急増しています。一方、われわれが現在合成できる何百万という化合物のデータ ベースもあります。そこで、コンピュータを使って、それらの化合物が標的タンパク質の鍵穴に結合することができるかどうか調べることができれば、原理的には、 薬となる化合物を見つけ出すことができるわけです。これは構造ベース創薬 Structure-Based Drug Design (SBDD) とよばれています。
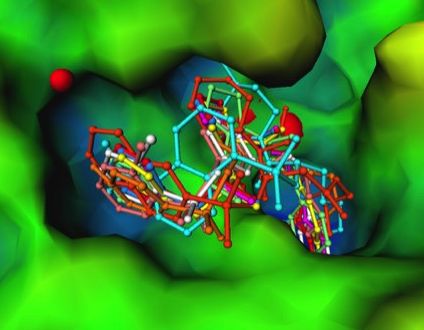
図7.2にSBDDのイメージ図を示しました。タンパク質の活性部位(鍵穴)をクローズアップした図で、鍵穴である活性部位の窪みが見られます。棒モデル で描かれた複数の化合物は、この鍵 穴にフィットする可能性のあるものを化合物データベースから検索して得られたものです。しかしこの検索作業においては、一つの分子でもい ろいろな向きで置くことができますし、単に形の相補性だけでなく、化合物とタンパク質との間の物理・化学的な相互作用の適合性も考慮しなければなりません。そのため、医 学、薬学、生物学はもちろんのこと、物理学、化学、情報科学などの幅広い知識を動員する必要があります。そこで、バイオインフォマティクスという新しい学際的 な 学問分野が誕生しています。
最新の話題として、スーパーコンピュータで新型コロナウイルスの薬を探すという動画つきの記事が以下のサイトにあります。ただし、有料会員でないと一部しかみられま せん。しかし、動画は見られるようです。コンピュータ創薬が最先端の話題であることは感じていただけると思いますので、興味のある人は覗いてみてくださ い。 「コロナ薬 を 探せ あのスーパーコンピューター後継の挑戦」 (外部リンク)
最後に、最も身近な薬である鎮痛・解熱剤の話題をとりあげます。 鎮痛・解熱剤の標的タンパク質はシクロオキシゲナーゼ(COX)という酵素で、その働きを阻害します。この酵素は、アラキドン酸を基質とし、最終的にプロスタグランジンを 生成する化学反応の最初の段階を担っています。したがって、プロスタグランジンの生 成を抑制することで治療効果が現れるというものです。そこで、まずは、プロスタグランジンの作用から見てみましょう。
プロスタグランジンは、それが分泌される部位によってさまざまな作用を引き起こすシグナル伝達物質(ある種のホルモン)です。たとえば、われわれの身体に 細菌やウイルスな どの病原体が侵入すると、免疫系はこれに対抗するため炎症反応を引き起こします。炎症は一般にわれわれにとって不快な症状を呈するため、意図に反したもののように思われま すが、細胞や組織 が傷害された際にこれを取り除いて再生するために生体が引き起こす反応で,あくまで生体にとっては重要な防御反応なのです。典型的な炎症反応の一つが発熱です が、こ れによりウイルスの活動を抑えることができます。その他にも、免疫細胞の活躍する場を準備するための血管の拡張、血管の透過性の亢進などがあり、それによって 腫れや痛みが生じます。筋肉痛も、運動によって傷ついた筋繊維を修復しようとして起こるある種の免疫系の反応で、筋繊維で炎症反応が起きています。その結果、 筋膜が刺激され、感覚中枢を介し痛みと感じていると考えられています。こうした炎症反応の引き金を引くのがプロスタグランジンなのです。
傷を負ったときに感じる痛みは生命を維持する上で重要なシグナルです。このとき傷口付近では発痛物質が放出され、それを受け取った痛覚神経が痛みを脳に伝 えます。このとき プロスタグランジンも放出され、痛みに対する反応性を高め、結果として痛みを増強する働きをします。生理痛にもプロスタグランジンは関わっています。月経時の 直前から前半、経血を排出するため子宮の収縮を促進するようプロスタグランジンがシグナルを発信します。しかし分泌が多すぎると強い生理痛を引き起こすことに なります。
こうしたことから、プロスタグランジンは重要な役割を担っているのですが、度を過ぎるとわれわれには不快となり、それがストレスとなって逆に症状を悪化し かねないわけで す。そこで、プロスタグランジンの合成を阻害すれば、鎮痛・解熱の効果が得られるというわけです。一方、痛みのメカニズムが異なる片頭痛、胃潰瘍の痛み、神経性 の痛みには効果がありません。
解熱・鎮痛剤にお世話になったことがある人は多いと思います。薬の説明書を覗いてみてください。アセチルサリチル酸(アスピリン)、イブプロフェン(パブロン、セデ ス)、インドメタシン(バンテリン、サロンシップ)、ジクロフェナク(ボルタレン)、ロキソプロフェン(ロキソニン)などの成分名が書かれていると思います。 これらはすべて酵素シクロオキシゲナーゼを標的とし、その機能を阻害するために開発された薬なのです。
ただし、プロスタグランジンには胃粘液の分泌を促進し、胃を守る働きもあります。これも阻害されてしまうと胃粘膜が荒れる副作用を引き起こします。したがって、胃粘膜を 守る薬も同時に処方されるのが一般的です。
薬の標的は酵素だけではありません。この後の回でも、酵素ではないタンパク質を標的とした薬の話題を取り上げます。今回の話に興味をもたれた方は、身近な「薬名」ととも に「作用機序」と入力して検索してみてください。薬の作用メカニズムなど読んでもまったく歯が立たなかったものが、少し理解できるようになっているかもしれま せん。