第23回から第25回まで免疫の話をしましたが、今回はそこでこぼれた話題をいくつか取り上げてみようと思います。以下の各節は独立した話題です。これま での話を理 解しているとより深くその内容がわかると思いますが、一方で、新たな種類の細胞や化学物質も登場します。しかし、一つ一つ丁寧には説明しませんので、詳しく知り たい方は自分で調べていただければ幸いです。
人体には異物を排除する免疫機能が備わっています。したがって、花粉を異物として認識すれば、それを排除するための活動が体内に起こるのは当然といえま す。 しか し一方で、無害な食物や花粉に対しては、そうした反応が起きないように免疫寛容のメカニズムも働いており、誰でも花粉症症状や食物アレルギーを引き起こすわけ ではありません。しかしその仕組みに関しては、まだ十分には理解されていません。
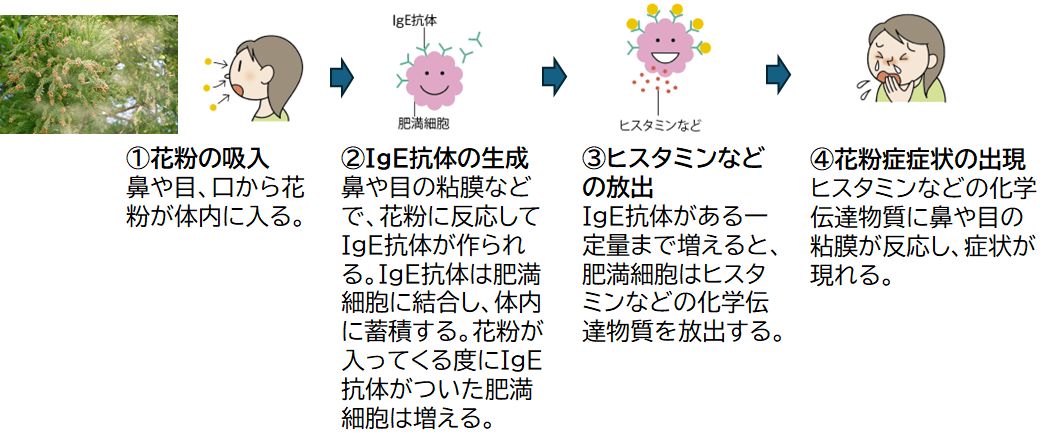
まずは、花粉症になった人が花粉に暴露されたとき、症状が出るまでの過程を見てみましょう(図26.1)。スギやヒノキなどの花粉が鼻などの粘膜に付着すると、マ クロファージや樹状細胞などの抗原提示細胞が花粉(抗原)を捕えます。それが異物と判断されると、その情報から2型ヘルパーT細胞 (Th2;これについては後で説明します) が量産され、Th2がインターロイキン4 (IL-4) を分泌してその情報をB細胞に伝えます。するとB細胞は、花粉に対する免疫グロブリンE (IgE) 抗体の量産を開始します。

IgE抗体は、目や鼻や喉の粘膜に多く存在する肥満細胞 (マスト細胞ともいう) に付着すると、肥満細胞がどんどん肥大化し、新たに侵入してきた花粉と大量に増 えたIgE抗体が次々とこれに結合し、肥満細胞や好塩基球からヒスタミンなどの化学伝達物質が粘膜に大量に放出されます。そして、くしゃみや鼻水や痒みなどの さまざまな花粉症症状を引き起こします。これらはあくまでも異物である花粉を体外へと排出するための免疫応答ですが、われわれにとってはきわめて不快な症状で あるわけです。
ところで、上記の説明の中に、2型ヘルパーT細胞(Th2)という用語が出てきました。実はヘルパーT細胞にはいくつか種類があることがわかってきました。 Th1細胞、Th2細胞、Th17細胞、Thf細胞などの種類が知られています。このうちTh1細胞とTh2細胞がもっともよく調べられており、この2種類の ヘ ルパーT細胞のバランスが崩れるとアレルギーを発症するという説明がこれまで大方でした。しかし、最近では、そう単純な図式では語れないこともわかってきていま す。しかしせっかくですので、一応、Th1細胞とTh2細胞について触れておきましょう。
Th1細胞は、サルモネラなどの細胞内に寄生して増殖する細菌「細胞内寄生細菌」や「ウイルス」に対する感染防御を得意とします。そのために大きく次の3 つ のこ とを行います。すなわち、マクロファージやナチュラルキラー細胞などの食細胞の活性化、キラーT細胞の活性化、そしてB細胞の活性化です。食細胞やキラーT細 胞による異物の排除が中心となっているので、主に細胞性免疫を促進するとされています。
一方、Th2細胞は、寄生虫に対して働く免疫細胞です。大きく以下の2つのことを行います。すなわち、B細胞の活性化および好酸球などの活性化です。好酸
球 は
色々な炎症物質を含んでおり、寄生虫に取りついて炎症物質を寄生虫に向けて放出し、寄生虫を退治します。B細胞に働きかけて抗体を産生させるので、主に体液性
免疫を促進するとされます。
また、Th1細胞は、Th2細胞の分化を抑制するサイトカインを出し、逆にTh2細胞は、細胞の分化を抑制するサイトカインを出すこともあり、互いを牽
制する仲でもあります。このように、Th1細胞とTh2細胞はお互いを制御しながらバランスを保っていると考えられており、Th1とTh2のバランスが崩れ、
Th2優位に傾くことにより、炎症やアレルギーなどの疾患が生じると説明されていました。また、Th2は本来、寄生虫に対応する免疫細胞ですが、寄生虫がほと
んど
いなくなった地域においては、働き場所を失ったTh2が過剰に花粉などに応答しているなどとする説も提唱されています。しかし、他の種類のヘルパーT細胞の働
き なども明らかになってくると、Th1とTh2のバランスを用いた単純な図式だけでは語られなくなっているようです。
われわれを外敵から守ってくれる免疫も、ときとして暴走することがあります。アレルギーもある意味その範疇に入りますが、それがさらに激しくなるとアナ
フィ
ラキシーを起こしたり、新型コロナではサイトカイン・ストームという言葉も話題になりました。さらには自己免疫疾患といった問題を引き起こすことがあります。
これらについて簡単に触れておきましょう。
(1) アナフィラキシーは、皮膚や粘膜に多くある肥満細胞の表面にあるIgE抗体が、対応する抗原(ピーナッツ、そば、ハチ毒などがもつそれぞれ特定のタンパク質)が侵入してき て、これに結合したとき、肥満細胞からヒスタミンなどの化学物質が一気に放出されて、蕁麻疹などの皮膚症状のほか、急速に血圧低下や呼吸困難、意識障害などが 起こって、生命を脅かすような危険な状態に陥ってしまうものです。
また、好塩基球とよばれる免疫細胞がその表面にあるIgG抗体に抗原が結合して活性化すると、ヒスタミンよりはるかに強い作用をもつ血小板活性化因子を放出
して、アナフィラキシー・ショックを起こすことがあることもわかっています。
(2)
免疫細胞の活性化や機能抑制には、サイトカインと総称される免疫細胞間のコミュニケーションを担うタンパク質が重要な役割を担っています。サイトカインには、白血球が分泌
し、
免疫系の調節に機能するインターロイキン類、白血球の遊走を誘導するケモカイン類、ウイルスや細胞の増殖を抑制するインターフェロン類など、さまざまな種類が
あり、今も新たなサイトカイン発見が続いているほど多種多様です。また、サイトカインには、「炎症性サイトカイン」と「抗炎症性サイトカイン」があります。こ
れらはアクセルとブレーキの関係になっていて、一方が炎症を引き起こし、他方がそれを抑えています。通常は、両者のバランスが取れており、不都合が起きないよ
うに制御されていますが、このアクセルとブレーキのバランスが崩れることがあります。そして免疫系のバランスの乱れなどによってこれらサイトカインの制御がう
まくいかなくなると、サイトカイン・ストームと呼ばれるサイトカインの過剰な産生状態を引き起こし、ひどい場合には致死的な状態に陥ります。
(3)
自己免疫疾患は、異物を認識し排除するための役割を持つ免疫系が、自分自身の正常な細胞や組織に対してまで過剰に反応し攻撃を加えてしまうことで症状を起こす疾患の総称で
す。関節リウマチ、潰瘍性大腸炎、多発性硬化症などさまざま症状が知られています。その原因については不明な点が多いですが、たとえば、本来排除されるべき自
己抗原に結合するB細胞受容体が生き残り、自分のタンパク質に結合する抗体を産生し続けることや、思春期に最大となりその後縮退する胸腺によるT細胞の選別が
十分に機能しなくなるなどの理由が考えられています。
ワクチンの形態としては、病原体を弱毒化して生きた状態のまま接種する生ワクチン、病原体を殺した不活化ワクチン、病原体の一部だけを投与する成分ワクチ
ン
があります。最近話題になっていますが、mRNAワクチンというのも新たに登場しました。そのなかで最も効果があるのは生ワクチンですが、反面、安全性という
観点からは弱毒化したとはいえ突然変異して猛毒化する可能性は否定できないため、なかなか使用し難いワクチンでもあります。そのため、特殊な場合を除いては、
不活化ワクチンや成分ワクチンが普及しています。mRNAワクチンも、ウイルスのRNAの一部を接種することで、われわれの体内でウイルスの成分を合成するこ
とを意図したものです。さらに、抗原を最小化して、エピトープ部分(抗体が結合する部分)だけの純粋な形にしていけば、副反応はさらに少なくなりますが、免疫
原性
も弱くなるというジレンマに陥ります。免疫原性とは、体液性免疫(抗体の産生)や細胞性免疫(T細胞)を誘導する能力のことです。免疫原性と安全性はコインの
裏表のように切り離すことが難しく、理想的なワクチン開発の上で最も大きな課題となっています。
免疫原性が高まらない理由の一つは、成分ワクチンの場合、自然免疫が誘導されないためで、病原体の成分をワクチン抗原とする場合には、強力なアジュバント
の
添加が必要となります。アジュバントとは、自然免疫を誘導する補助的な添加物です。しかし、どのようなアジュバントが有効かについてはまだ十分な理論が確立し
ていないことや、強力なアジュバントでは副反応も強い傾向にあるといった問題もあり、ワクチンの設計を難しいものにしています。しかし、自然免疫研究のより新
たな展開により、自然免疫を担当する細胞がもつパターン認識受容体に結合する種々の物質が明らかになってきています(第24回
24.3パターン認識受容体
参照)。たとえば病原体の膜成分、核酸などがそれで、それらをアジュバントとして添加すれば免疫原性が増強される可能性が高いことなどがわかってきています。
抗原とアジュバントを巧みに組み合わせることで副作用の少ない効果的なワクチンができるよう、今後の進展が期待されています。(いま話題のmRNAワクチン
は、mRNA自身がアジュバントとしての機能も有すると考えられています。また、mRNAを脂質分子にくるんで接種するため、その脂質分子がアジュバントの役
割をもつという説もあります。まだ詳しい作用機序についてはあまり報道されていません。)
ちなみに、生ワクチンには、代表的なものとして、MR(麻疹風疹混合)、麻疹、風疹、水痘(みずほうそう)、BCG(結核)、おたふくかぜなどがありま す。不 活化ワクチン・成分ワクチンの代表的なものとしては、DPT−IPV四種混合(D:ジフテリア・P:百日せき・T:破傷風・IPV:不活化ポリオ)、DT二種 混合、日本脳炎、インフルエンザ、A型肝炎、B型肝炎、肺炎球菌、不活化ポリオなどがあります。新型コロナも不活化ワクチン・成分ワクチン(mRNAワクチン も含む)で開発されています。
あまり聞き慣れませんが、トキソイドとよばれるワクチンもあります。これは細菌の産生する毒素(トキシン)を取り出し、免疫原性はあるが毒性は無いように
した ものです。不活化ワクチンとして分類されることもあります。上記のジフテリア、破傷風のワクチンはトキソイドです。
一度感染した病原体を「記憶」していて、同一病原体の再感染時には初回より遙かに効率よく排除する仕組みを免疫記憶といいます。免疫記憶は細胞性免疫(T 細 胞)と体液性免疫(B細胞)のどちらにも生じます。
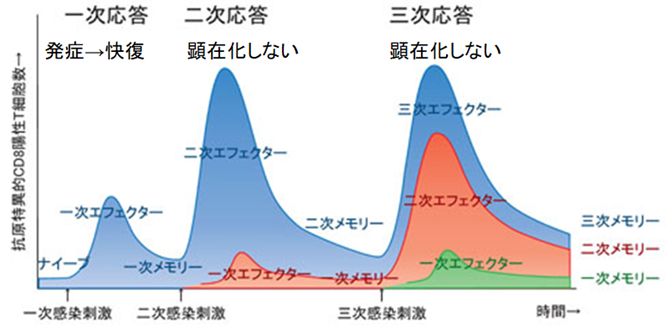
図26.2 免疫記憶のメカニズム
たとえば、抗原と出会う前のナイーブキラーT細胞は抗原提示細胞から抗原を提示されると24時間目以降から爆発的な分裂増殖期に入り、多数のエフェクターT
細
胞(抗原に感作されたT細胞)を産出します。エフェクターT細胞は非自己抗原ペプチドをMHCとともに発現している細胞を認識し、これを排除した後、大半が死
滅します。しかし、ピーク時の細胞数の一定数(5〜10%程度)がメモリーCTL(細胞障害性T細胞=キラーT細胞)として残存し、長期にわたって個体内で維
持されます。
一回目の感染で一次応答として形成された一次メモリーCTLは、二次感染時の二次応答ではより迅速かつ強力に分裂して対応し、症状が顕在化しません。ま
た、こ
の二次応答時にも二次メモリーCTLが形成され、二次感染終了後の個体内には二次メモリーCTLと一次メモリーCTLが共存することになります。さらなる感染
応答(三次感染)では、直近に形成されたメモリーCTLが応答の主体をなし、感染後新たなメモリーCTLが加わって、細胞集団全体として分裂応答能が維持、強
化されると考えられています。またB細胞についても、同様な仕組みがあるとされています。
「二度なし」といって一度感染すると二度と罹らないのが免疫の特徴とされますが、このモデルによれば、症状が顕在化しなくても再度感染しており、その都度
その
感染症への免疫が強化されていると考えられます。麻疹は「二度なし」の典型例としてよく取り上げられますが、最近若い人に二度罹る人が見られるようになったこ
とも話題となっています。数世代が同居する大家族の時代には、家族内に麻疹に罹る人がいる確率が高く、再度感染する機会が多いことで麻疹への免疫力を高めてい
ました。しかし、核家族化によって再度感染する機会が減り、十分に麻疹に対する免疫が持続できず発症しているという説明は、こうしたモデルを根拠にされている
の ですが、十分な証拠があるわけではありません。
免疫研究の最前線では、腸管における免疫システムがホットな課題となっています。そこで、NHKスペシャル「人体第4集:
万病撃退!“腸”が免疫の鍵だった」2018年1月14日放送
https://www.nhk.or.jp/kenko/special/jintai/sp_6.html
の解説記事から、その冒頭部分を引用します。興味をもたれた方は、自分で「腸管免疫」をキーワードに、いろいろ調べてみてください。
「腸は、ウンチをつくるのが仕事の臓器」だなんて思っていませんか?実はいま、日ごろおなかを壊した時くらいしか意識することのない「腸」が、世界の研究者
か
ら大注目されています。食べた物を消化吸収する腸には、「全身の免疫を司る」という秘められた重要な役割があったのです。いま話題の「腸内細菌」が、腸に集結
する「免疫細胞」と不思議な会話を交わしながら、私たちの全身をさまざまな病気から守る「免疫力」をコントロールしている。そんな驚きの腸の実像が見えてきま
した。
腸は、食べ物だけでなく、それと一緒に病原菌やウイルスなどが常に入り込んでくる危険性のある場所。体内で最も密接に“外界”と接する臓器と言えます。だ
から
こそ腸には、病原菌やウイルスなどの外敵を撃退してくれる頼もしい戦士「免疫細胞」が大集結しています。その数、なんと体中の免疫細胞のおよそ7割!それほど
大量の免疫細胞が、栄養や水分を吸収する腸の壁のすぐ内側に密集して、外敵の侵入に備えているのです。
それだけではありません。腸の中には、全身から寄せ集めた免疫細胞の“戦闘能力”を高めるための、特別な「訓練場」まで用意されていることがわかってきまし
た。それが、「パイエル板」と呼ばれる、小腸の壁の一部に存在する平らな部分です。パイエル板の表面には、腸内を漂うさまざまな細菌やウイルス、食べ物のかけ
らなどの「異物」を、わざわざ腸の壁の内部(つまり体内)に引き入れるための“入り口”が用意されています。そこから引き込んだ「異物」を、パイエル板の内側
に密集する大量の免疫細胞たちに触れさせ、人体にとって有害で攻撃すべき敵の特徴を学習させているのです。
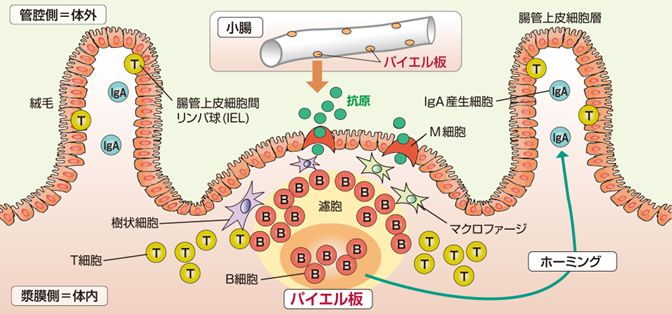
図26.3 腸管免疫系:小腸の壁に存在する腸管バイエル板とそれを構成する細胞群
上野川修一『食品免疫・アレルギーの事典』(日本食品免疫学会編、朝倉書店、2011)
こうした腸での訓練を受けた免疫細胞たちは、腸で守りを固めるだけでなく、血液に乗って全身にも運ばれ、体の各所で病原菌やウイルスなど敵を見つけると攻
撃
する“戦士”となります。一見腸とは無関係に思えるインフルエンザや肺炎などに対する免疫力の高さも、腸での免疫細胞の訓練と密接に関係しているらしいこと
が、最新研究でわかってきています。腸はまさに「全身の免疫本部」。
ところが近年、体を守るよう腸でしっかり訓練されているはずの免疫細胞が「暴走」し、本来攻撃する必要のないものまで攻撃してしまうという異常が、現代人
の
間に急増しています。それが、さまざまな「アレルギー」や、免疫細胞が自分の細胞を攻撃してしまう「自己免疫疾患」と呼ばれる病気です。最新研究によって、こ
うした免疫の暴走が招く病気の患者さんに「腸内細菌の異常」が生じていることが明らかになってきました。(以下略)
この辺りで免疫の話は終わりにしたいと思います。新型コロナへの対応を見てもわかる通り、免疫にはまだわからないことがいっぱいあります。これまでの免疫の
教科書に書かれていた内容では理解できないようなことも起きています。これまでの講義資料を読んでいてもいろいろな疑問が湧いているかもしれません。一つには
私の説明が足りないからだと思いますが、一方で、免疫学自身がまだ十分に明らかにしていない事象がたくさんあるという側面もあるのです。免疫は身近な生命現象
です。この講義を端緒に、免疫についていろいろ調べてみることも面白いことと思います。
![]()